VATS肺叶切除术治疗合并重度COPD的非小细胞肺癌
肺癌是严重危害人类健康和生命的疾病,近年来其在世界范围内的发病率和死亡率呈明显上升趋势,在全球范围而言,无论是对于发达国家还是发展中国家,肺癌的发病率和死亡率均己跃居至癌症的首位[1]。虽然手术治疗已被公认为是治疗早期非小细胞肺癌的最有效的方法,但由于许多吸烟的肺癌患者多伴有慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD),这些患者往往由于COPD而导致肺功能损害,从而增加肺部手术后的并发症的发生。因此,既往肺癌合并重度COPD是进行肺叶切除术的禁忌证。但随着国内外肺减容手术的不断开展, 人们发现部分重度肺气肿患者在切除部分病变肺组织后, 肺功能可得到不同程度的改善[2]。随着研究的不断进行,有文献报道证实,肺癌合并重度COPD的患者在接受肺叶切除术后,患者的肺功能会有所好转[3-5]。因此,肺癌合并COPD的肺叶切除手术适应证得到重新的认识。
电视胸腔镜肺叶切除术治疗肺癌最早于1992年开始应用,其最大优势在于其创伤小,术后的疼痛减少,对呼吸肌和术后肺功能损伤小[6]。而且有文献报道[7],在肺叶切除术后的早期阶段,采用VATS手术的患者的肺功能的恢复明显要好于接受开胸手术的患者,这就更加表明了VATS手术因对呼吸肌创伤的较少而具有保护肺功能的作用。随着电视胸腔镜手术(Video-Assisted Thoracoscopic Surgery,VATS)的广泛运用及麻醉、重症监护技术以及术前呼吸功能管理的不断提高,肺切除手术适应证也在不断扩大,越来越多高龄或长期吸烟合并肺功能损害的肺癌患者获得手术治疗机会。目前已有少数文献报道使用VATS肺切除手术治疗肺癌合并重度COPD,并取得了较好的短期及长期效果[8]。但到目前为止,文献报道的VATS肺叶切除术治疗肺癌合并重度COPD的病例数均较少,不足以全面了解VATS肺叶切除术治疗肺癌合并重度COPD这一治疗方法的有效性和安全性。本文旨在通过对我科61例重度COPD肺癌患者实施VATS肺叶切除术,以了解此类患者进行微创肺叶切除术的手术安全性及疗效。
资料和方法
临床资料
回顾性分析了从2000年1月至2011年1月广州医学院第一附属医院所有接受VATS肺叶切除术的非小细胞肺癌的临床资料,从中选取了合并有重度COPD的患者61例,所有入选患者的COPD评级标准参考GOLD标准[9]。所有入选患者术前均常规接受相关术前准备工作:戒烟、呼吸功能锻炼、化痰药物、胸部理疗等。
术前检查及手术方法
所有入选患者在术前均进行了体格检查、常规血液学检查、心电图、心脏彩色超声检查、下肢深静脉彩超超声检查。在呼吸功能方面的检测包括:肺通气-弥散功能检测、肺通气灌注核素扫描。对于60岁以上怀疑有冠心病的患者进行冠状动脉CT检查或运动平板活动实验,必要时行冠状动脉介入检查。
术前的肿瘤分期主要依靠胸部X线检查、胸部CT、头腹部MRI、全身骨显像、纤维支气管镜,术前分期被认为是Ⅱ期以上的均建议进行PET/CT检查。
所有患者均接受VATS肺叶切除联合肺门及纵隔淋巴结清扫,具体手术方法我们在之前的文献中已经报道[10]。
数据收集及随访
收集整理所有入选患者的人口统计数据、吸烟情况、肺功能检测结果、手术时间、术中出血、术后住院时间、术后胸管停留时间、术后肿瘤分期、术后并发症情况以及术前术后ECOG评分结果。术后并发症包括:围术期死亡率(任何原因引起的在住院期间或术后30天内出现的死亡),严重并发症(手术相关:因术后出血的二次开胸手术;呼吸方面:ARDS、支气管胸膜瘘、肺炎、肺栓塞、脓胸、肺水肿、气管切开或重新气管插管;心脏方面:心肌梗死、心肌缺血或心绞痛、脑血管意外、深静脉血栓;其他:急性肾衰竭、急性消化道出血等);轻度并发症(肺不张、术后漏气时间超过7天、胸腔积液、房颤或其他心律失常、伤口感染等)。
长期随访的内容包括:呼吸情况、肿瘤复发情况、生存情况,随访时间1~60个月。
统计学分析
计量资料表达均数±标准差(X±SD),患者术前术后的ECOG评分变化的关联性分析采用列联表χ2检验,患者术后生存时间的相关性采用Kaplan-Meier生存分析;单因素分析中P≤0.20的变量均进行Cox回归模型检验。统计学分析使用SPSS 13.0软件包进行,P<0.05认为有统计学意义。
结果
临床资料
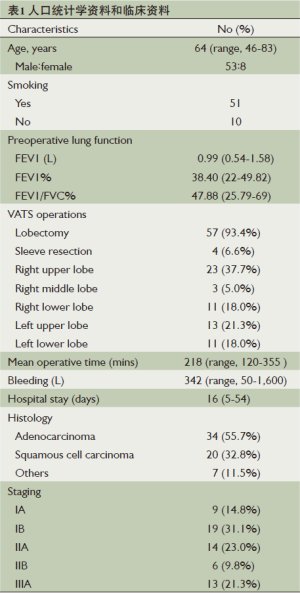
共有61例患者最终入选本次回顾性研究中,其中男性53例(86.9%),女性8例(23.1%)(表1)。平均年龄64岁(46~83岁)。51例患者有长期吸烟史。所有患者术前FEV1/FVC<70%,FEV1%<50%,术前平均FEV1为0.99 L (0.54~1.58 L),平均FEV1%为38.4%(22%~49.82 %)。
Full table
61例患者接受了VATS肺叶切除或袖状切除术加系统淋巴结清扫术[右上肺叶23例(37.7%),右中肺叶3例(4.9%),右下肺叶11例(18.0%),左上肺叶13例(21.3%),左下肺叶11例(18.0%)]。平均手术时间218 分钟(120~355分钟),平均术中出血量为342 mL(50~1600 mL),无1例患者中转为开胸手术。术后病理类型显示:腺癌34例(55.7%),鳞癌20例 (32.8%),其他类型肿瘤7例(11.5%)。依照UICC第7版定义的TNM分期对所有患者的肿瘤进行病理分期及临床分级[11],分别为:ⅠA 9例(14.8%),ⅠB 19例 (31.1%),ⅡA14例(23.0%),ⅡB 6例(9.8%),ⅢA13例(21.3%)。
术后并发症
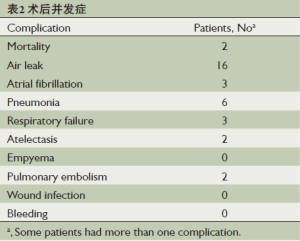
术后围术期有2例患者因ARDS死亡,24例(39.3%)患者出现术后并发症(表2)。22例(36.1%)患者术后出现呼吸相关并发症,其中漏气16例(25.8%),肺部感染6例,呼吸衰竭3例,肺不张2例,肺栓塞2例。平均住院时间为16±1.1天(5~54天)。
Full table
总生存期
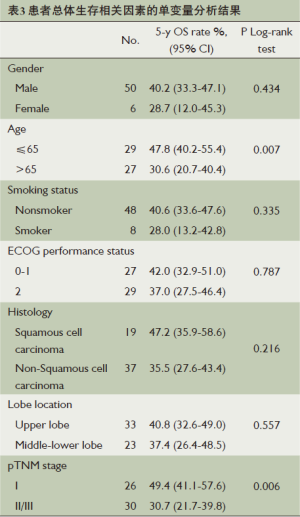
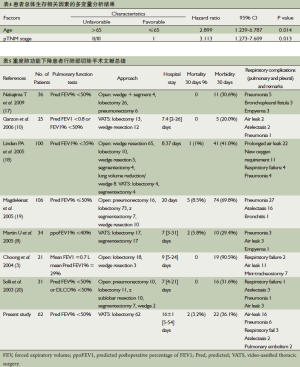
中位随访时间为39个月(1~60个月),本次研究中有5例患者失访,27例患者死亡。第1年的生存率为75.4%, 5年生存率为50.9%(图1)。通过Log-rank test的单变量分析结果发现,患者的年龄、术后TNM分期与患者的预后有着相关性(P=0.007和P=0.006)(表3);年龄小于等于65岁的患者的中位生存时间为48个月,而大于65岁患者的中位生存时间为31个月(P=0.007,图2);Ⅰ期中位生存时间为49个月,而Ⅱ/Ⅲ期中位生存时间为28个月,两者之间有明显统计学差异(P=0.006,图3)。单变量分析中对生存情况有显著影响的所有变量经过Cox回归模型分析后发现,患者的年龄、肿瘤术后TNM分期是预测患者5年生存率的一个独立相关因素(表4)(P=0.014和P=0.013)。
Full table
Full table
为评估患者在手术后肺功能及生活质量的变化情况,我们在术前及术后3个月检测患者的ECOG评分[12]。结果显示:除去2例围术期死亡病例,59例患者术前和术后的平均ECOG评分分别为:1.51和1.31,两者具有统计学差异(P<0.05)。
讨论
肺癌和COPD是两种常见的疾病,肺癌合并有COPD的患者由于存在肺功能的损害从而增加肺部手术后的并发症风险。合并有重度COPD的肺癌患者术后并发症发生率更加高,因此,虽然肺叶切除术是目前认为治疗早期肺癌最有效的手段,但合并有重度COPD的肺癌患者往往也只能接受非根治性的部分肺切除术(楔形或肺段切除)。但是对于肺癌患者来说,肺楔形切除或肺段切除的肿瘤复发率要明显高于标准的肺叶切除术,且术后的生存率相对于后者也较低[13,14]。
但随着肺减容手术的不断开展,人们发现对肺癌伴有肺气肿患者行部分肺切除术也能取得肺减容手术同样的效果[3],可以减少术后肺功能的损失甚至还可能有所改善,从而使人们对治疗合并有重度COPD肺癌患者的手术方式的选择有了新的认识。并且,随着手术技术、麻醉和重症医学技术的不断发展,越来越多的文献报道称合并有重度肺功能不全的肺癌患者可以耐受肺切除术,且术后预后较好[3,8,15-18]。
自20世纪90年代初以来,电视胸腔镜手术(VATS)在世界范围内得到飞速发展和迅速普及,其应用范围几乎涉及普胸外科的各个领域。与开胸手术相比,VATS手术切口小,无须切除或撑开肋骨,避免患者呼吸肌受到破坏,从而使得患者的肺功能损失较小。而且,由于切口较小而使得患者术后疼痛轻,利于排痰,减少术后肺部感染的发生率,也进一步降低了术后并发症的发生率。由于VATS手术有着上述的这些优点,因此近年来逐渐出现使用VATS手术治疗合并有重度肺功能不全的肺癌患者的文献报道[8,19]。
虽然既往研究表明,肺癌合并COPD患者对比正常肺癌患者在接受肺叶切除手术后,患者术后的心肺并发症增多[20]。本研究中,有2例患者在围术期因呼吸衰竭而死亡,24例(39.3%)患者出现术后并发症,其中22例(36.1%)患者术后出现呼吸相关并发症,术后平均住院时间为16天。对比既往文献报道,本研究中的术后呼吸系统并发症的发生率并不是不可接受的(表5)。从既往文献报道中我们可以看出,对于合并有重度肺功能不全患者肺癌患者,开胸手术无论是术后住院时间以及呼吸系统并发症的发生率方面均要高于VATS手术,这就更加体现了VATS手术在治疗合并有重度肺功能不全肺癌患者上的优势。这可能与VATS手术对呼吸肌的损伤少以及胸壁创伤小而引起的疼痛较轻有关,由于VATS手术更加便于术后患者咳嗽排痰和下地活动,这样就降低了术后肺部感染可能,从而进一步减少了呼吸系统其他并发症发生的可能性。本研究中的肺部并发症的发生率为36.1%,较多数开胸手术文献报道的要低[3,16,17],但较VATS手术文献报道的要高[8]。Martin[8]等在对34例术后预测FEV1%<40%的肺癌患者进行VATS肺切除手术,在术后围术期有2例患者出现死亡,但只有10例(29.4%)患者出现呼吸相关的并发症。在本研究中,虽然我们的术后呼吸系统并发症的发生率较上述文献报道[8]的要高。但是由于本研究中报道的所有的重度COPD合并肺癌患者接受的是系统的肺癌根治手术,而上述文献中,VATS肺叶切除手术所占总病例的比率为50%[8],肺叶切除手术的创伤及肺泡功能面积丧失要远大于肺楔形切除及肺段切除,而且在本研究中还有7例患者属于极重度COPD,术前FEV1%仅为27.8%(22%~29.9%)。
本研究中术后患者的住院时间较长,平均达到16天,除了比Magdelein等[17]报道的平均20天住院时间稍短外,均长于其他文献报道,究其原因可能与手术方式有着很大的关系。本研究中,所有61例患者均接受了肺叶切除或袖状切除术,而在其余文献报道中,肺叶切除手术所占的比例均相对较少。
在进行了5年的随访后,本研究中合并重度COPD的肺癌患者在接受肺叶或袖状切除术后,取得了较好的短期及长期生存率。经过生存分析后,术后1年生存率为75.4%,5年生存率为50.9%,这与Magdeleinat[19]报道的术后1年生存率基本一致,但要高于Magdeleinat所报道的术后5年的生存率。我们进一步的分析结果显示,Ⅰ期肺癌患者的预后要明显好于Ⅱ~Ⅲ期,5年生存率分别为73.1%和32.3%(P<0.05),这与文献报道的生存率基本一致[8,15,17]。Martin等[8]报道称,在对34例接受VATS肺叶或肺段切除的合并重度肺功能不全Ⅰ期肺癌患者进行分析后发现,患者的5年生存率达到69.7%,且在接受肺叶切除或肺段切除这两组患者间生存率无明显差异。Nakajima等[15]发现,36例合并重度肺功能不全的肺癌患者在接受肺切除术后,Ⅰ期肺癌患者的5年生存率为57.9%,而其他分期的5年生存率仅为11.9%。
肺癌和COPD发患者群多为老年患者,其中65岁以上的患者约占50%以上,而70岁以上的患者占30%~40%[21]。吸烟的老年肺癌患者多合并有COPD以及心脑血管性疾病,这些伴随疾病的存在可能直接或间接地影响着患者的治疗和预后。Janssen- Heijnen等[22]研究发现,在Ⅰ和Ⅲ期NSCLC患者中,年龄是影响患者生存的一个独立预后因素;但对于Ⅲ和Ⅳ期患者,年龄对患者的生存预后则无明显影响。Li Z[23]等也发现在Ⅰ期肺癌患者中,年龄≤65患者的5年生存率要显著高于>65岁患者。我们在前期一项研究中也发现,年龄因素可作为预测患者预后的一个重要因素[24]。对于合并有重度肺功能不全的肺癌患者,有多个研究发现[15,17,25],Ⅰ期肺癌患者术后的预后要显著优于Ⅱ/Ⅲ期患者(P<0.05)。在本研究中,我们经过多变量统计分析也发现在合并重度COPD的肺癌患者中,年龄也是影响患者预后的一个独立因素,这与之前的报道基本一致。
由于本研究是一个回顾性分析,还存在着许多局限性。虽然本文是目前所报道VATS肺叶切除术治疗合并重度COPD肺癌例数最多的一个研究,但病例数仍较少。其次,本文仅仅分析了术后患者5年总生存率,而未观察患者的疾病进展时间,而且在观察患者的5年生存率时未将患者在术后接受的后续治疗的影响包含在内。最后,由于本文有部分患者未进行术后肺功能的检测,因此我们无法进行术前术后肺功能的一个客观数据的对比,仅仅只能从一些相对客观的指标进行分析,从而了解患者术前术后生活质量的变化情况。为了进一步了解VATS肺叶切除术治疗合并重度COPD的非小细胞肺癌的安全性和有效性,我们还将需要进一步进行一些全面的前瞻性研究。
总之,合并重度COPD的非小细胞肺癌患者在深度评估后接受VATS肺叶切除手术是安全、有效的,术后并发症也在可接受范围,长期生存效果不低于常规的VATS手术。因此,我们初步认为,合并重度COPD的非小细胞肺癌患者,如果患者较为年轻且分期早(Ⅰ期),接受VATS肺叶切除术可取得较好疗效。
Acknowledgements
Disclosure: The authors declare no conflict of interest.
References
- Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin 2011;61:69-90. [PubMed]
- Zeng Q, Jiang S. Update in diagnosis and therapy of coexistent chronic obstructive pulmonary disease and chronic heart failure. J Thorac Dis 2012;4:310-5. [PubMed]
- Choong CK, Meyers BF, Battafarano RJ, et al. Lung cancer resection combined with lung volume reduction in patients with severe emphysema. J Thorac Cardiovasc Surg 2004;127:1323-31. [PubMed]
- Zhong N. Nipping it in the bud: An inspiring mission for prevention and management of COPD. J Thorac Dis 2012;4:102-5. [PubMed]
- Korst RJ, Ginsberg RJ, Ailawadi M, et al. Lobectomy improves ventilatory function in selected patients with severe COPD. Ann Thorac Surg 1998;66:898-902. [PubMed]
- Richards JMJ, Dunning J, Oparka J, et al. Video-assisted thoracoscopic lobectomy: the Edinburgh posterior approach. Ann Cardiothorac Surg 2012;1:61-9. [PubMed]
- Hennon MW, Demmy TL. Video-assisted thoracoscopic surgery (VATS) for locally advanced lung cancer. Ann Cardiothorac Surg 2012;1:37-42. [PubMed]
- Martin-Ucar AE, Nakas A, Pilling JE, et al. A case-matched study of anatomical segmentectomy versus lobectomy for stage I lung cancer in high-risk patients. Eur J Cardiothorac Surg 2005;27:675-9. [PubMed]
- Pauwels RA, Buist AS, Calverley PM, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary. Am J Respir Crit Care Med 2001;163:1256-76. [PubMed]
- He J, Shao W, Cao C, et al. Long-term outcome and cost-effectiveness of complete versus assisted video-assisted thoracic surgery for non-small cell lung cancer. J Surg Oncol 2011;104:162-8. [PubMed]
- Goldstraw P, Crowley J, Chansky K, et al. The IASLC Lung Cancer Staging Project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classification of malignant tumours. J Thorac Oncol 2007;2:706-14. [PubMed]
- Berrisford R, Brunelli A, Rocco G, et al. The European Thoracic Surgery Database project: modelling the risk of in-hospital death following lung resection. Eur J Cardiothorac Surg 2005;28:306-11. [PubMed]
- Warren WH, Faber LP. Segmentectomy versus lobectomy in patients with stage I pulmonary carcinoma. Five-year survival and patterns of intrathoracic recurrence. J Thorac Cardiovasc Surg 1994;107:1087-93; discussion 1093-4. [PubMed]
- Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 1995;60:615-22; discussion 622-3. [PubMed]
- Nakajima T, Sekine Y, Yamada Y, et al. Long-term surgical outcome in patients with lung cancer and coexisting severe COPD. Thorac Cardiovasc Surg 2009;57:339-42. [PubMed]
- Linden PA, Bueno R, Colson YL, et al. Lung resection in patients with preoperative FEV1 <35% predicted. Chest 2005;127:1984-90. [PubMed]
- Magdeleinat P, Seguin A, Alifano M, et al. Early and long-term results of lung resection for non-small-cell lung cancer in patients with severe ventilatory impairment. Eur J Cardiothorac Surg 2005;27:1099-105. [PubMed]
- Solli P, Leo F, Veronesi G, et al. Impact of limited pulmonary function on the management of resectable lung cancer. Lung Cancer 2003;41:71-9. [PubMed]
- Demmy TL, Curtis JJ. Minimally invasive lobectomy directed toward frail and high-risk patients: a case-control study. Ann Thorac Surg 1999;68:194-200. [PubMed]
- Pompili C, Brunelli A, Refai M, et al. Does chronic obstructive pulmonary disease affect postoperative quality of life in patients undergoing lobectomy for lung cancer? A case-matched study. Eur J Cardiothorac Surg 2010;37:525-30. [PubMed]
- Yancik R. Cancer burden in the aged: an epidemiologic and demographic overview. Cancer 1997;80:1273-83. [PubMed]
- Janssen-Heijnen ML, Smulders S, Lemmens VE, et al. Effect of comorbidity on the treatment and prognosis of elderly patients with non-small cell lung cancer. Thorax 2004;59:602-7. [PubMed]
- Li Z, Yu Y, Lu J, et al. Analysis of the T descriptors and other prognosis factors in pathologic stage I non-small cell lung cancer in China. J Thorac Oncol 2009;4:702-9. [PubMed]
- Wang W, Xu X, Wang W, et al. The expression and clinical significance of CLIC1 and HSP27 in lung adenocarcinoma. Tumour Biol 2011;32:1199-208. [PubMed]
- Lau KK, Martin-Ucar AE, Nakas A, et al. Lung cancer surgery in the breathless patient--the benefits of avoiding the gold standard. Eur J Cardiothorac Surg 2010;38:6-13. [PubMed]
(译者:王炜;校对:何建行)
(本译文仅供学术交流,实际内容请以英文原文为准。)





