病理在肺癌治疗中的关键角色
引言
肺癌相关的死亡仍然是全球癌症死亡率最高的疾病之一[1]。在澳大利亚,2009年癌症占所有死亡病例的29.8%,仅次于循环系统疾病。气管、支气管和肺部恶性肿瘤是男性中癌症相关死亡的首要原因(20.1%),超过了女性中的乳腺癌(16.5%)[2]。目前,以治愈为目的的外科手术切除是肺癌的主要治疗手段,但绝大多数患者就诊时处于晚期,药物治疗成为唯一可用的治疗方法。确诊为肺癌的患者预后很差,5年总生存率仍低于15%[3-7]。这部分是由于缺乏相对有效的早期诊断方法,以及对晚期患者缺少治愈性手段。
然而,在过去的10年中,用于研究肺癌和其他癌症的高级的分子生物学技术得到了飞速发展,我们对肿瘤生物学复杂性的认识和兴趣也成倍增长。得到共识的是,肺癌是形态学、分子和遗传变异多种复杂联合作用的结果,最终导致产生具有癌症“标志性”表型的恶性肿块[8]。多分子转化的累积最终导致抑癌基因(TSG)和癌基因之间的不平衡,使得细胞具有恶性转化的潜能[9]。特别是体细胞在关键性癌基因上的突变是肺癌发生的潜在“驱动”事件,并引出“癌基因依赖(oncogene addiction)”[10,11]的概念。识别和分析这些“驱动”事件的特征,可以推动针对肺癌特定亚型的靶向治疗的发展。这些能够改善预后的进展,要求诊断和治疗的多学科规划,并且极大扩展了外科病理学家的作用,再不仅仅是明确恶性的诊断,还要基于肿瘤的组织学和分子谱系进行准确分类。由于大多数肺癌诊断是基于活检或细胞学标本,这些标本往往是通过日益先进的诊断程序而得到的,病理学家必须从这些小而有价值的组织样本中得到最大的诊断获益。
本综述对肺癌的组织学分类最新进展进行全面评述,并且指出在肺癌个体化治疗时代,外科病理学家所面临的挑战。
肺癌的分类
世界卫生组织(WHO)的分类适用于手术切除的肺和胸膜恶性肿瘤[12]。传统上,原发性肺癌被分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。非小细胞肺癌约占所有原发性肺癌的80%,主要组织学类型是腺癌,鳞状细胞癌(SCC)和大细胞癌[13,14]。IASLC/ATS/ERS肺腺癌分类的最新修订版反映了组织学、发病机制(癌前病变)和临床行为的内容,该分类的细化使得可以在小活检和细胞学标本中诊断肺癌。
癌前病变
肺癌前病变的发展使得人们一直有兴趣研究早期检测的方法和增加对肿瘤生物学的了解。众所周知,肺癌是多种形态学、分子和遗传改变的复杂联合作用的结果。研究已经令人信服地证明了遗传学改变和形态上异常上皮区域的共定位,并有证据表明一系列关键性遗传改变通过增加异型性,使得肿瘤进展,最终导致浸润性肺癌[15-20]。
肺鳞状细胞癌,典型的来自大的、近中央气道的支气管上皮,通过一系列浸润前肿瘤性病变,从鳞状上皮化生到鳞状上皮不典型增生(轻度,中度和重度),最后形成原位癌(CIS)而进展[12,21](图1A-C)。多种分子改变推动了这一多阶段进展,包括3p21(一个早期事件)、9p21、8p22 –24、5q22和17p的杂合性丢失、端粒酶活性的异常调节(deregulation)、 p53突变、细胞增殖( cyclin D1和E)和凋亡(Bcl -2 )的异常调节(Wistuba and Gazdar 2006; Lantuejoul et al. 2009综述)[22,23]。
相反,肺腺癌主要为周围型肿瘤,被认为起源于肺泡或支气管上皮细胞(肺泡细胞或Clara细胞)[22]。IASLC/ATS/ERS新分类规定浸润前腺癌病变包括非典型腺瘤样增生(AAH)和原位腺癌(AIS)[21](图2)。这些病变的分子改变并没有像对应的鳞状上皮癌变中那样得到很好的了解,但已经认识到,不吸烟者通过表皮生长因子受体(EGFR)信号通路的改变,而吸烟者通过v-Kiras2基尔斯滕大鼠肉瘤病毒癌基因(KRAS)信号通路的改变而发生进展(Wistuba 和 Gazdar 2006综述)[22]。这反映了一个事实,即AIS是一种浸润前病变,完整切除后5年生存率达100%[24-30]。
对于肺的其他肿瘤而言,还不清楚癌前病变导致浸润性肿瘤的发展过程。弥漫性特发性肺神经内分泌细胞增生(DIPNECH)被认为是类癌的一种癌前病变[12,21,22,31]。这是一种罕见的末端气道的病变,组织学特征为神经内分泌细胞呈单细胞、小结节状或线状弥漫增生,局限于气道腔上皮或形成腔外微小瘤,可伴有纤维化[12,22]。肺其他神经内分泌肿瘤还没有发现明确的癌前病变。然而,已经发现小细胞肺癌的邻近支气管上皮出现遗传性改变,即使其形态上是正常的[22,32]。因此认为,SCLC绕过了传统的多阶段癌前顺序,直接起源于没有或仅有最轻微异型性的上皮细胞[22,32]。
为什么要对非小细胞肺癌进行分类?
非小细胞肺癌的具体亚型显示对不同的化疗药物有不同反应。肺腺癌的关键原癌“驱动”事件包括KRAS和EGFR的互相排斥性激活突变[33]。EGFR激活突变(外显子18-21)导致表皮生长因子受体酪氨酸激酶抑制剂(EGFR - TKI),如吉非替尼和厄洛替尼的后续研发,彻底改变了这些突变肿瘤患者的治疗[33-36]。值得注意的是,KRAS突变几乎只出现在吸烟者的腺癌组织中,而EGFR突变与不吸烟、腺癌、女性、亚裔有关,吸烟状况可能是最强的EGFR-TKI反应的临床预测因素[37-40]。发生于不吸烟者和吸烟者的肺癌存在较多临床病理学及分子差异,这一特点支持目前的理论,即它们均为一种独特的疾病(Sun et al., 2007综述)[40]。
一定比例的肺腺癌出现涉及ALK基因(编码一种酪氨酸激酶)和一些配体(通常是EML4)的易位,导致癌基因ALK蛋白的过度表达[41-44]。对于分别有EGFR突变和ALK易位的患者,目前推荐EGFR-TKIs(吉非替尼和厄洛替尼)和ALK-TKIs(克唑替尼)作为一线治疗方案[45]。LASIC联合美国病理学家协会(CAP)和分子病理学协会(AMP),发表了关于EGFR突变和ALK易位的检测指南,其建议所有肺腺癌,无需考虑其临床特征,都应该进行EGFR突变和ALK易位的确证性分子检测[46]。非小细胞肺癌中其他潜在的驱动性“事件”包括KRAS、BRAF、HER2和FGFR1的突变[33,47-52]。许多这些基因的靶向抑制剂正处于临床开发的各个阶段,有可能在未来进行靶向治疗,但这将需要在非小细胞肺癌患者的诊断检查中进行额外的分子检测。
对于最有可能受益于特定的分子靶向治疗的患者而言,分子生物标志物不仅可以被用来发现他们,还可以帮助预测对药物的治疗反应。初步研究表明,培美曲塞主要的酶靶标——胸苷酸合成酶(TS)在小细胞肺癌和鳞癌中高表达,而在腺癌中低表达[53-55]。在临床试验中发现,与腺癌中的疗效相比,培美曲塞在小细胞肺癌和鳞状细胞癌中的疗效降低,可能是由于TS水平较高[56]所致。因此有人建议,TS表达水平可能用于预测培美曲塞的疗效[55]。同样,初步研究表明,在预测铂类为基础的化疗的临床反应时,ERCC1蛋白的表达可能是一个有用的生物标志物[57,58]。尽管它们在个体化靶向治疗肺癌患者中有潜在价值,但多数仍处于研发的早期阶段。
肿瘤组织学本身可能预测对治疗的反应。已报道应用血管内皮生长因子(VEGF)抑制剂贝伐单抗的治疗,在SCC患者中可发生危及生命的肺出血[59]。因此从接受该药物或培美曲塞治疗的患者中,需排除显示鳞状分化的肿瘤患者。
鳞状细胞癌
在最近的几十年里,全球范围内鳞状细胞癌在非小细胞肺癌中的比例有所下降,目前的报告估计约占33%[13]。这种变化部分是因为吸烟行为的改变。经典的SCC是中央型肺肿瘤(图3A),然而外周型也不少[30]。鳞状分化的形态学特征包括细胞间桥、单个细胞角化和角化珠形成[14](图3B-D)。目前世界卫生组织的分类包括乳头状型、透明细胞型、小细胞型和基底细胞样亚型SCC[12]。除了基底细胞样鳞状细胞癌,其余亚型并没有明确的临床或预后价值。
一些文献提出了SCC分类的补充方法。 Maeshima等人[2006]发现与那些大的(>6个细胞)或小的(2~5细胞)的浸润性肿瘤细胞巢相比,单个细胞浸润的肿瘤预后较差[60]。最近Travis的综述[2011]建议取消小细胞型的描述,因为其会与真正的小细胞肺癌相混淆,并指出小细胞亚型与基底细胞亚型存在重叠[61]。将来SCC的分型需要有意义的临床病理协作,以建立相应的关于治疗反应和预后的预测参数。
腺癌
腺癌现在是所有肺癌的主要组织学亚型,特别在非吸烟,女性和亚洲患者中是最常见的肺肿瘤[62,63]。它们主要起源于外周肺组织(图4A),组织学特征是出现腺体分化和/或产生黏液[12,21]。在2011年,IASLC/ATS/ERS经过协作努力,提出了手术切除肺腺癌的一种新的分类[21]。值得注意的是,细支气管肺泡癌(BAC)这一含义混乱的术语被放弃。分类引入了AIS(以前指的BAC)和微小浸润性腺癌(MIA)术语,如果完全切除,两者的5年生存率接近100%[24-30]。MIA被定义为一种贴壁为主型的肿瘤,直径小于3厘米,浸润性成分不超过5毫米[21]。组织学上,这些病变可为非黏液性或很少黏液,有特征性的影像学表现[21]。
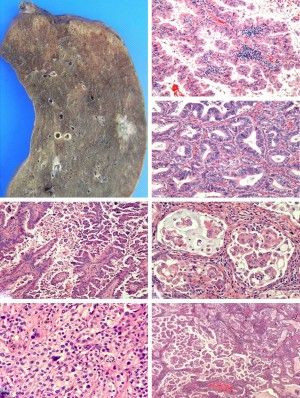
对于手术切除的浸润性腺癌,新的IASLC/ATS/ERS分类引入了一些重要变化以反映其异质性。因为绝大多数病例显示混合性组织学模式,分类推荐记录主要的组织学模式[贴壁型、腺泡型、乳头状型、微乳头状型或实性型(图4B-F)],病理报告中列出的其他次要成分以5%的增量进行记录[21](图4G)。该分类第一次引入了微乳头状结构,因为多个研究报告指出,如果早期肺腺癌出现该种成分,则预后不良[21,61,64-66]。透明细胞型和印戒细胞型不再属于腺癌的组织学亚型,而是被认为在许多肺癌亚型中的细胞学变异型,仍然可以报道它们的存在[21,61]。肺腺癌的这种报告规则允许列入可能具有预后价值(例如,微乳头)和导致肺腺癌结构分级的微小成分[21,61,67]。
IASLC/ATS/ERS分类规定了四种腺癌亚型:浸润性黏液腺癌(前身为黏液性BAC),胶样腺癌,胎儿型(低级别或高级别)和肠型腺癌[21]。浸润性黏液腺癌被划分为一种腺癌亚型,因为这些肿瘤与KRAS突变强相关,缺乏TTF-1的表达,且常为多中心性[21,61],因此与非黏液型腺癌不同。和非黏液型腺癌一样的是,黏液腺癌可以显示不同比例的贴壁生长、腺泡型、乳头型或微乳头结构模式,富含黏液[2,61]。
一些研究采用了新的IASLC/ATS/ERS分类,初步结果表明,推荐的病理亚型可能有助于风险分层和确定临床预后不佳的患者。如前所述,AIS和MIA与极好的预后相关[24-30,64,68-70]。以乳头型和腺泡型模式为主要的组织学亚型预后居中,而浸润性黏液腺癌或胶样腺癌,或存在显著的实性或微乳头状生长者预后较差[64,68,69]。
大细胞癌
LCC约占所有肺癌的3%[71-73],其本质上是一种排除性诊断,肿瘤没有诊断为腺癌、鳞状细胞癌或小细胞癌的形态特征[12,61]。往往是大的,部分坏死的肿瘤(图5A),癌细胞为大的多角形,有泡状核和突出的核仁[12](图5B),成片或成巢分布。虽然目前的WHO分类完全是基于组织学表现,事实上经过超微结构(电镜)、免疫表型(IHC)或分子特征检测[61]后,许多这些未分化的肿瘤显示有腺,鳞癌或NED的证据。最近Travis的综述[2011]提出,LCC的诊断标准应保持不变,但如果在常规形态之外,肿瘤显示有鳞癌或腺癌分化的证据[61],就应该在病理报告中注明。
由于LCC是一种排除性诊断,只能基于手术切除标本对肿瘤整体进行组织学评估,排除局灶分化后才能作出诊断。因此,不能在小活检或细胞学标本中作出LCC的诊断,按照新的IASLC/ATS/ERS建议,这些病例应被归为非小细胞肺癌,非特指类型(见下文)[21,61]。2004年的WHO分类确定的LCC亚型包括大细胞神经内分泌癌(LCNEC),基底细胞样癌,淋巴上皮瘤样癌,透明细胞癌和具有横纹肌样表型的LCC[12]。 LCNEC将在下面进一步详细讨论。
神经内分泌肿瘤
神经内分泌肿瘤约占所有肺癌的20%~25%[74,75],形成一组具有共同的形态学、分子、免疫组织化学(IHC)和超微结构特点的肿瘤,从而与其他肺部肿瘤相区别[12]。2004年WHO分类将肺神经内分泌肿瘤分为4类:SCLC、LCNEC、典型类癌(TC)和不典型类癌(AC)[12]。组织学上,这些肿瘤展示出不同程度的神经内分泌形态,包括器官样巢团、栅栏状、小梁生长和花环样结构。是否出现坏死和核分裂比例是区别这四种神经内分泌肿瘤的主要组织学特征[12]。
小细胞肺癌
小细胞肺癌是一种高度侵袭性的神经内分泌恶性肿瘤,约占所有肺癌的12%~14%[71,76]。绝大多数患者在诊断时就已有转移性疾病,所以很少选择手术切除。其生存率依然令人失望,其5年生存率只有5%~8%[74,76]。
小细胞肺癌是一种上皮性恶性肿瘤,癌细胞很小(小于3个静息淋巴细胞的直径),具有鲜明的细胞学特征,包括细胞边界不清,胞浆少,核染色质细颗粒状,无明显核仁(图6A,也见于表1)[12]。常见挤压的人工假象(核染色质涂抹)和核铸型,但在其他恶性肿瘤中也可存在(例如,淋巴浸润中常见挤压的人工假象)。核分裂率高(≥11核分裂/10 HPF),且常有广泛坏死[12]。小细胞肺癌的组织学特征很明确,使得可以在小活检和细胞学标本中进行可靠诊断,对于有显著挤压假象的小样本来说,使用一组免疫组化标记如广谱细胞角蛋白、神经内分泌标记(嗜铬素、突触素和CD56)和/或TTF-1和Ki-67,可以证实所怀疑的SCLC[61,77](图6B-D)。在细胞角蛋白阴性的病例中,重要的是要考虑和排除其他诊断,如淋巴瘤、慢性炎症、小圆细胞肿瘤或原始神经外胚层瘤[21,61,78]。
2004年WHO分类规定了两种亚型的SCLC:纯的和混合型[12]。混合型SCC的定义是在典型的SCLC中,含有任何NSCLC亚型特征的成分,最多为鳞状细胞癌、腺癌或LCC[12,61]。如果非小细胞性成分为腺癌或SCC时,并不需要非小细胞成分所占的比例。但是如果为小细胞和大细胞癌(SCLC-LC)混合,则大细胞成分必须超过10%[12,61]。
大细胞神经内分泌癌
LCNEC是另外一种高度侵袭性的神经内分泌恶性肿瘤,肿瘤细胞显示NSCLC的细胞学特征(表1),但具有神经内分泌结构(器官样瘤巢、栅栏状、小梁状和花环状结构),IHC染色至少有一种神经内分泌标记阳性(嗜铬素、突触素或CD56)[12]。和小细胞肺癌一样,这些肿瘤往往出现坏死,核分裂像多(≥11个/10 HPF)[12]。它们可能是纯的LCNEC或混合有其他类型的非小细胞肺癌[12]。
由于在不同类型肿瘤间存在重叠[61,77],LCNEC的诊断往往具有挑战性。特别是在细胞学样本中SCLC和LCNEC的鉴别尤其困难,因为核的大小有重叠,并且一些LCNEC的核仁并不明显。目前还没有免疫组化染色可鉴别SCLC和LCNEC,其鉴别仅仅是基于细胞学特征(如表1所详述的)。LCNEC与其他NSCLC肿瘤的鉴别是根据是否出现神经内分泌的形态,以及IHC染色至少有一种神经内分泌标记阳性[12]。然而,高达20%的非小细胞肺癌(腺癌、鳞状细胞癌和LCC )没有明显的神经内分泌形态,但神经内分泌标记的IHC染色阳性[12,61]。目前,这些肿瘤被划分为伴神经内分泌分化(NED)的非小细胞肺癌亚型(如,NSCLC-NN)[12]。无神经内分泌形态的NSCLC出现NED的IHC证据时,其临床意义尚不清楚,需要进一步研究。
类癌
类癌占肺肿瘤的1%~2%[74,75],是儿童最常见的肺肿瘤[79]。有两个亚型:典型类癌(TC)和不典型类癌[12]。两者都具有反映NED的形态学生长模式(器官样、小梁状、岛状、栅栏状、缎带状、花环样结构)[12]。鉴别TC和AC的诊断标准是核分裂像和是否出现坏死。TC为<2个/10 HPF,没有坏死。相反,AC显示坏死(通常为局灶性或点状)和/或2~10个核分裂/10 HPF[12]。
其他非小细胞肺癌亚型
腺鳞癌
腺鳞癌在肺癌中的比例小于5%[80-82],被定义为分别含有至少10%的鳞和腺性分化的非小细胞肺癌[12]。与LCC相似,诊断必须基于组织学和免疫表型。然而,有可能在即将到来的肺癌分类中,出现更新的指南以及使用免疫组织化学对其特征进行的定义。腺鳞癌只能在手术切除的样本中明确诊断,但如果小活检或细胞学标本中显示鳞状上皮和腺体分化,可以提示该诊断[21]。
肉瘤样癌
肉瘤样癌是一种低分化的非小细胞肺癌,显示肉瘤或肉瘤样(梭形和/或巨细胞)分化的形态特征,约占所有肺癌的1%[12]。2004年WHO分类提出5种亚型,包括多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤[12]。这些高度侵袭性的肿瘤被认为是出现异向分化的上皮恶性肿瘤[12,83-87]。因为这些肿瘤具有异质性,不应该在小活检或细胞学样本中诊断。相反,IASLC/ATS/ERS分类建议使用 “伴有梭形和/或巨细胞癌的低分化非小细胞肺癌” 的诊断[21]。值得注意的是,新的IASLC/ATS/ERS分类将胎儿型腺癌视为一种腺癌变异型,而不是肺母细胞瘤的一种上皮性模式[21,61,88]。
涎腺型癌
支气管腺体产生的唾液腺肿瘤是罕见的,不到所有肺癌的1%[21]。 2004年WHO分类提出3种亚型,包括黏液表皮样癌,腺样囊性癌和上皮–肌上皮癌[12]。
肺的其他原发性肿瘤
和在任何器官或组织中一样,肺的原发性肿瘤可起源于任何类型的细胞,并不仅仅来自于上皮细胞。在“非上皮”肺肿瘤当中,2004年的WHO分类描述了包括间质淋巴组织增生及杂类肿瘤(例如,黑色素瘤,生殖细胞肿瘤)在内的多种肿瘤[12]。在2004年的WHO分类中可以见到这些肿瘤类型的详细描述[12],不在本篇综述的介绍范围。
诊断挑战
患者出现多发性肺肿瘤时,对外科病理学家而言是一种诊断挑战。区分真正独立的原发性肺癌、原发肿瘤的卫星病灶或肺内转移是至关重要的,因为其临床治疗及预后显著不同。在30年前,多处原发性肺癌可分为同时性(同时检测或诊断出)或异时性(两个独立的原发病灶的检测或诊断之间存在时间间隔)[89-91]。为帮助诊断比较常见的异时性肿瘤,IASLC/ATS/ERS腺癌分类强调了不仅仅要报告腺癌的主要模式,也需要详细报告5%增量百分比的各种组织模式的重要性[21]。这使得可以对后来发生的腺癌进行更好的比较,特别是无法得到原发肿瘤的切片时[21]。
在大多数病例中,对多个肿瘤进行综合性组织学和细胞学检查,可以鉴别原发性和转移性肺癌[92]。但是,还存在一定比例的多个肺肿瘤病例,尽管进行了仔细的病理组织学检查和免疫组化分析,仍然不可能明确区分多个原发性肺癌和转移性肺癌[89,90,93]。为协助诊断,需要了解详细的临床病史和进行多学科讨论。遗传学研究显示,组织学相似的多个肿瘤具有独特的分子表型,提示在未来这些肿瘤的分子分析可提供较高的诊断准确性[90,91]。
原发性肺癌和转移癌的鉴别是外科病理学家所面临的另一个诊断挑战,尤其是在小活检和细胞学标本上。当最初的标本组织学检查没有明确提示为肺原发性恶性肿瘤时,就必须考虑转移性疾病[61]。肺癌的特定亚型可能难以与转移性疾病鉴别,如肺腺癌伴肠型分化时,其形态学和IHC特征与结直肠腺癌类似[21,94]。但是,由于肺肿瘤具有异质性,可以找见更典型的肺分化区域[21]。例如,贴壁生长提示原发性腺癌[21],但罕见的情况下,转移性腺癌可能会出现这种扩散模式(个人观察)。
转移性头颈部鳞状细胞癌(HNSCC)与肺鳞癌的鉴别是一个独特的诊断挑战,由于类似的病因和危险因素,它们可以表现出类似的形态,可以发生于同一个患者[95-98]。最近研究提示,P16可作为一个潜在的免疫组化标记来区分头颈部鳞癌和肺鳞癌,阴性染色倾向于肺鳞状细胞癌,阳性染色支持肺外鳞状细胞癌[99]。然而,一定比例的原发性肺鳞状细胞癌可以阳性表达P16[100],这可能反映了HPV感染与肺癌的发展之间相关性有限,据报道HPV的感染率为5%~22%[101,102]。目前,还没有可靠的免疫组化标记鉴别肺鳞癌和头颈部鳞状细胞癌[99,103,104]。在怀疑为转移性病变时,提供详细的临床病史(即,先前恶性肿瘤和部位的病史)非常重要,因为它可以指导详细的形态学和免疫组化评估,并避免因为做多个IHC指标染色而浪费宝贵的组织。
小活检和细胞学——非小细胞肺癌诊断的现状
肺肿瘤WHO分类是为手术切除肺肿瘤的病理诊断和分期而开发和设计的。然而,绝大多数患者处于局部晚期或已有转移,不能进行手术切除,因此肺癌的诊断是基于小活检和/或细胞学。随着针对肺癌亚型和分子靶向治疗的到来,对准确的组织学分类的需求、对靶向分子特征的需求,都更加需要外科病理学家在更少的组织上做出更多的工作。
最近发表的IASLC/ATS/ERS分类第一次提供了临床所关注的,适用于小活检和细胞学标本的相关分类应用。腺癌和鳞状细胞癌的鉴别尤其具有临床重要性,因为这将指导随后的分子检测和治疗方案的选择。如果一个肿瘤显示出明确的腺癌或鳞状细胞癌组织学特征,就应该使用标准的诊断术语[21,61]。对于低分化癌,IASLC/ATS/ERS建议使用一组IHC标记(下面讨论的)来区分腺癌和鳞状细胞癌,在保留组织进行分子检测的同时,有效地减少NSCLC-NOS(非特指)这一术语的使用。
当然,在评估小活检/细胞学标本时必须考虑替代性诊断,在这个过程中,从治疗医生那里得到相关的临床病史很必要。不仅仅是潜在的良性疾病,其他肺原发性和转移性恶性肿瘤都需要加以考虑。病理学家和临床医生需要知道肿瘤所固有的异质性,并认识到小活检/细胞学标本是仅仅占整个肿瘤中很小的一部分样品,事实上,非小细胞肺癌亚型(MIA、LCC、腺鳞癌)的明确诊断只能基于手术切除标本。对小活检/细胞学标本,IASLC/ATS/ERS建议分类为非小细胞肺癌,描述所见到的形态学特征,以及是否可做出特定的诊断,例如,非小细胞肺癌伴神经内分泌形态(神经内分泌标记阳性)——可能为LCNEC[21]。
限制性使用“非小细胞肺癌-非特指”
再也不能简单的把肺肿瘤分为非小细胞肺癌或小细胞肺癌。现在的临床适应证强烈需要外科病理学家进一步对非小细胞肺癌进行分型,尤其是区分腺癌和鳞状细胞癌,甚至是在小活检/细胞学标本上。与以前世界卫生组织的分类相反,现在IASLC/ATS/ERS建议限制使用NSCLC-NOS这一术语。必须采用所有可用的临床材料,并在细胞学和组织学标本之间进行联系[21]。事实上,Sigel等人[2011]报道,当将细胞学与小活检样本进行联系时,NSCLC-NOS的诊断率是4%,比原来的单独细胞学诊断的11%和活检诊断的6%下降了[105]。
对于经过组织学或细胞学检查,仍然难以鉴别的肿瘤而言,需要做一组组织化学和IHC标记(图7A-D)。最广泛使用的腺癌标记物包括粘蛋白(淀粉酶或黏液卡红的过碘酸-希夫染色)、TTF-1(甲状腺转录因子1)和napsin-A,SCC的推荐标记是p63和CK5/6。其中,TTF-1和p63针对其各自的非小细胞肺癌亚型而言,具有最高的灵敏性[21,106-111]。在不确定的病例中,可以考虑做替代性IHC标记CK7(腺癌)和34βE12 (鳞状细胞癌),但其敏感性和特异性较低,往往不被列入常规的IHC检测指标[108,110-113]。最近发现一个标记P40(ΔNp63),是SCC的一个相对较新的免疫组化标记。现有的p63 IHC染色检测的是p63基因的所有异构体,而p40只特异性检测非反式激活或截短形式的p63,不考虑组织起源时,P40检测SCC的特异性增加了[107,114-120]。
文献中已经讨论了鉴别肺腺癌和SCC的大量诊断性IHC套餐,大多包括TTF-1和p63,含有或者不含有第三或第四种抗体。例如,Rekhtman和他的同事们[2011]最近报道在小活检标本(手术切除标本确诊)中使用TTF-1和p63做为一线抗体,可疑病例加做CK5/6,其准确性达到100%[106]。IASLC/ATS/ERS建议使用单一的腺癌标志物(TTF-1)和SCC标记物(P63),加或者不加做黏蛋白染色,可以鉴别大多数的非小细胞肺癌(表2)[21,61]。如果IHC结果支持腺癌(TTF - 1阳性和/或黏蛋白阳性,P63阴性),肿瘤应分类为:“非小细胞肺癌,支持为腺癌”[21,61]。当IHC结果支持为SCC时(P63阳性,TTF–1和黏蛋白阴性),肿瘤应分类为:“非小细胞肺癌,支持为鳞状细胞癌”[21,61]。只有当没有任何形态学或IHC证据支持明确的谱系分化时,肿瘤才应被分为NSCLC-NOS。在有经验的病理学家和细胞病理学家手中,加以客观的免疫组化染色,ASLC/ATS/ERS估计只有不到5%的非小细胞肺癌病例应被划分为NSCLC-NOS[21,61]。
非小细胞肺癌的分子检测
肺腺癌分子靶向治疗的发展不仅使我们重新审视NSCLC诊断的分类和指南,也在组织的采集和处理方面产生了重大影响。这些越来越小的诊断活检和细胞学标本不能再仅仅是用于确认恶性和肿瘤分型,还需要有足够的肿瘤组织用于分子检测,以完成病理诊断评估。需要考虑的因素包括标本采集、实验室的组织处理、分子检测的要求、为分子实验室提供足够的样品,以及需要及时将结果反馈给治疗医生。因此,外科病理学家必须加入多学科小组,以制定战略性的指南,确保为患者提供完整的组织学和分子诊断[61]。
为了得到最好的诊断获益,关键是要保证采样组织的数量和充足性。虽然采样程序及方法的选择在很大程度上取决于病灶本身(即大小,位置)、患者因素(例如,合并症)和可用资源,但应该鼓励病理学家同时收集细胞学和活检标本(如果可能),从而有助于提高诊断的准确性。训练有素的细胞病理学家和细胞学技师可以进行非超声引导下的细针穿刺活检,并对样本充足性进行快速现场评估(ROSE),这不仅要确认样品来自于目标病变区域,还要确保收集到足够的样本[121,122]。由于种种原因,还不能在每一个机构应用ROSE[123]。有趣的是, Alsharif等人[2010]发现,远程病理可以成功地用于评估细针抽吸(FNA)得到的标本是否充分[120]。
一旦收集了标本,必须要提供足够的临床病史,以确保该标本的处理方式将能制出足够的诊断切片以及进行分子检测。IASLC/ATS/ERS指南强烈推荐外科病理学家尽可能减少用于诊断的组织量,尤其是减少一线IHC染色指标的数量(如上所述)[21]。另一个推荐的策略是对蜡块进行“连续切片”,保存未染色的切片,以避免在修块时造成不必要的损失,虽然这里面存在一个小的风险,即切片后没有短期内使用,切片的DNA或抗原表位的质量可能会降低[124,125]。
目前,EGFR激活突变是非小细胞肺癌中最明确、使用最广泛的分子生物标志物。其他分子生物标志物也可使用,但ALK易位除外,IASLC/CAP/AMP不建议常规检测ALK易位[46]。荧光原位杂交(FISH)仍然是ALK易位的临床试验推荐方法,但是IASLC/CAP/AMP认为可以在正式的FISH检测之前,将ALK的免疫组化作为筛选患者的一种方法[46]。
快速,准确的EGFR突变检测的发展为其临床应用提供了重要的数据。传统的EGFR突变检测金标准要求提取肿瘤DNA进行直接测序,这是一种耗时的方法,灵敏度低(要求高质量的肿瘤DNA)。EGFR突变的较新的验证方法灵敏度更高(需要较少的肿瘤细胞),缩短了发报告时间,并可以对更多样化的临床样本进行检测。目前EGFR突变检测技术可以是筛选(检测所有突变,包括新的突变,即测序)或有针对性的方法(仅检测已知突变)。当然,这两种方法都有其独特的优势和劣势(Ellison等人的综述,2013年)[126],以及不同机构之间使用的检测方法会有所不同。因此,外科病理学家必须知道他们当地的分子实验室可用的检测方法和特定的组织要求。
一旦做出肺腺癌的诊断,就必须决定患者需要进行什么合适的分子检测。由外科病理学家发起的“反馈性”分子检测(类似于浸润性乳腺癌的HER2检测)是一个有争论的话题,根据不同机构和政府的司法管辖区而异。外科病理学家可能没有意识到,如果患者准备做手术,就可能得到更有代表性的组织样本。相反,延迟分子检测可能会导致治疗的延误。对于小活检/细胞学确诊为NSCLC-NOS的患者,IASLC/ATS/ERS推荐进行生物标志物检测(EGFR和ALK)[21]并进行多学科会议,制定进一步的检测和治疗方案。
外科病理学家的角色演变
外科病理学家的唯一角色不再仅仅是对肺恶性肿瘤进行组织学诊断,以及区别小细胞肺癌和非小细胞肺癌。他们对于肺癌的诊断、治疗和研究的贡献是动态的和不断发展的。肺癌个体化医疗的出现带来了新的挑战和驱动性重大变化。值得注意的是,这是IASLC/ATS/ERS提出的第一个基于小活检和细胞学标本的肺癌结构分类,也是肺腺癌的一个新分类。这两者都提高了病理诊断的临床意义,使外科病理学家与临床医生密切合作,以确保在临床上新概念的理解和应用。
随着个性化医疗的发展和分子检测在肺癌的临床应用,由于多数患者无法手术切除,诊断性的小活检或细胞学标本已经成为一种宝贵的资源,外科病理学家需要借此得到最大程度的诊断获益。外科病理学家成为这些有限的珍贵样品的守护者,评估标本是否充足,确保采用适当的处理技术,选择合适的切片或蜡块,如果需要则通过显微切割富集肿瘤成分,解释并及时提供结果给多学科的团队。
并且越来越重要的是,外科病理学家参与了临床试验和基础研究,这有助于获得病理和临床上有意义的数据。在可行的情况下,外科病理学家也可以帮助收集临床决策所不需要的研究组织(得到患者同意)。通过这种方式,现代外科病理学家成为多学科团队中的成员,在临床试验以及为肺癌患者决定合适、及时的治疗中发挥至关重要的作用。
结论
在过去的10年中,我们对于肺肿瘤生物学复杂性的理解得到了显著发展,最终使得我们进入了肺癌个体化医疗时代。确定肺癌治疗方案的核心不再仅仅是基本的组织学诊断和临床分期,最重要的是组织学亚型和分子检测。外科病理学家已经成为小活检/细胞学标本的守护者,必须基于有限而珍贵资源实现最大化的诊断获益。
Acknowledgements
Partial funding support for this work came from SPORE (P50CA70907) grant from the NCI, USA (AFG).
Disclosure: The authors declare no conflict of interest.
References
- Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010;127:2893-917. [PubMed]
- Australian Bureau of Statistics. Causes of Death Australia 2009. Australian Government, ABS. 2011. Accessed 26 February 2012.
- Naruke T, Tsuchiya R, Kondo H, et al. Implications of staging in lung cancer. Chest 1997;112:242S-8S. [PubMed]
- Nesbitt JC, Putnam JB Jr, Walsh GL, et al. Survival in early-stage non-small cell lung cancer. Ann Thorac Surg 1995;60:466-72. [PubMed]
- Australian Bureau of Statistics. Causes of Death, Australia, 2004. Australian Government, ABS. 2006. Accessed 2 October 2006.
- Jemal A, Clegg LX, Ward E, et al. Annual report to the nation on the status of cancer, 1975-2001, with a special feature regarding survival. Cancer 2004;101:3-27. [PubMed]
- Australian Institute of Health and Welfare (AIHW) Cancer Australia (CA) and Australian Association of Cancer Registries (AACR). Cancer survival and prevalence in Australia: cancers diagnosed from 1982 to 2004. Canberra: AIHW2008. Report No.: Cancer Series. No. 42: Cat. No. 38.
- Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000;100:57-70. [PubMed]
- Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell 1990;61:759-67. [PubMed]
- Weinstein IB. Cancer. Addiction to oncogenes--the Achilles heal of cancer. Science 2002;297:63-4. [PubMed]
- Pao W, Girard N. New driver mutations in non-small-cell lung cancer. Lancet Oncol 2011;12:175-80. [PubMed]
- Travis WD, Brambilla E, Muller-Hermelink HK, et al. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. WHO/IASLC classification of lung and pleural tumours. Lyon: IARC Press, 2004.
- Fong KM, Bowman RV, Fielding D, et al. Queensland integrated lung cancer outcomes project (qilcop): initial accrual and preliminary data from the first 30 months. Respirology 2003;8:A53.
- Kumar V, Abbas A, Aster J. Robbins Basic Pathology. 9th ed. Philadelphia, PA: Elsevier/Saunders, 2013.
- Auerbach O, Forman JB, Gere JB, et al. Changes in the bronchial epithelium in relation to smoking and cancer of the lung; a report of progress. N Engl J Med 1957;256:97-104. [PubMed]
- Auerbach O, Stout AP, Hammond EC, et al. Changes in bronchial epithelium in relation to cigarette smoking and in relation to lung cancer. N Engl J Med 1961;265:253-67. [PubMed]
- Zochbauer-Muller S, Gazdar AF, Minna JD. Molecular pathogenesis of lung cancer. Annu Rev Physiol 2002;64:681-708. [PubMed]
- Niklinski J, Niklinska W, Chyczewski L, et al. Molecular genetic abnormalities in premalignant lung lesions: biological and clinical implications. Eur J Cancer Prev 2001;10:213-26. [PubMed]
- Wistuba II, Gazdar AF. Characteristic genetic alterations in lung cancer. Methods Mol Med 2003;74:3-28. [PubMed]
- Wistuba II, Behrens C, Milchgrub S, et al. Sequential molecular abnormalities are involved in the multistage development of squamous cell lung carcinoma. Oncogene 1999;18:643-50. [PubMed]
- Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011;6:244-85. [PubMed]
- Wistuba II, Gazdar AF. Lung cancer preneoplasia. Annu Rev Pathol 2006;1:331-48. [PubMed]
- Lantuéjoul S, Salameire D, Salon C, et al. Pulmonary preneoplasia--sequential molecular carcinogenetic events. Histopathology 2009;54:43-54. [PubMed]
- Sakurai H, Dobashi Y, Mizutani E, et al. Bronchioloalveolar carcinoma of the lung 3 centimeters or less in diameter: a prognostic assessment. Ann Thorac Surg 2004;78:1728-33. [PubMed]
- Vazquez M, Carter D, Brambilla E, et al. Solitary and multiple resected adenocarcinomas after CT screening for lung cancer: histopathologic features and their prognostic implications. Lung Cancer 2009;64:148-54. [PubMed]
- Yamato Y, Tsuchida M, Watanabe T, et al. Early results of a prospective study of limited resection for bronchioloalveolar adenocarcinoma of the lung. Ann Thorac Surg 2001;71:971-4. [PubMed]
- Yoshida J, Nagai K, Yokose T, et al. Limited resection trial for pulmonary ground-glass opacity nodules: fifty-case experience. J Thorac Cardiovasc Surg 2005;129:991-6. [PubMed]
- Koike T, Togashi K, Shirato T, et al. Limited resection for noninvasive bronchioloalveolar carcinoma diagnosed by intraoperative pathologic examination. Ann Thorac Surg 2009;88:1106-11. [PubMed]
- Noguchi M, Morikawa A, Kawasaki M, et al. Small adenocarcinoma of the lung. Histologic characteristics and prognosis. Cancer 1995;75:2844-52. [PubMed]
- Tomashefski JF Jr, Connors AF Jr, Rosenthal ES, et al. Peripheral vs central squamous cell carcinoma of the lung. A comparison of clinical features, histopathology, and survival. Arch Pathol Lab Med 1990;114:468-74. [PubMed]
- Davies SJ, Gosney JR, Hansell DM, et al. Diffuse idiopathic pulmonary neuroendocrine cell hyperplasia: an under-recognised spectrum of disease. Thorax 2007;62:248-52. [PubMed]
- Wistuba II, Berry J, Behrens C, et al. Molecular changes in the bronchial epithelium of patients with small cell lung cancer. Clin Cancer Res 2000;6:2604-10. [PubMed]
- Herbst RS, Heymach JV, Lippman SM. Lung cancer. N Engl J Med 2008;359:1367-80. [PubMed]
- Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 2010;362:2380-8. [PubMed]
- Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009;361:947-57. [PubMed]
- Marks JL, Broderick S, Zhou Q, et al. Prognostic and therapeutic implications of EGFR and KRAS mutations in resected lung adenocarcinoma. J Thorac Oncol 2008;3:111-6. [PubMed]
- Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005;97:339-46. [PubMed]
- Shigematsu H, Gazdar AF. Somatic mutations of epidermal growth factor receptor signaling pathway in lung cancers. Int J Cancer 2006;118:257-62. [PubMed]
- Pham D, Kris MG, Riely GJ, et al. Use of cigarette-smoking history to estimate the likelihood of mutations in epidermal growth factor receptor gene exons 19 and 21 in lung adenocarcinomas. J Clin Oncol 2006;24:1700-4. [PubMed]
- Sun S, Schiller JH, Gazdar AF. Lung cancer in never smokers--a different disease. Nat Rev Cancer 2007;7:778-90. [PubMed]
- Palmer RH, Vernersson E, Grabbe C, et al. Anaplastic lymphoma kinase: signalling in development and disease. Biochem J 2009;420:345-61. [PubMed]
- Horn L, Pao W. EML4-ALK: honing in on a new target in non-small-cell lung cancer. J Clin Oncol 2009;27:4232-5. [PubMed]
- Camidge DR, Kono SA, Flacco A, et al. Optimizing the detection of lung cancer patients harboring anaplastic lymphoma kinase (ALK) gene rearrangements potentially suitable for ALK inhibitor treatment. Clin Cancer Res 2010;16:5581-90. [PubMed]
- Yi ES, Boland JM, Maleszewski JJ, et al. Correlation of IHC and FISH for ALK gene rearrangement in non-small cell lung carcinoma: IHC score algorithm for FISH. J Thorac Oncol 2011;6:459-65. [PubMed]
- Moreira AL, Thornton RH. Personalized medicine for non-small-cell lung cancer: implications of recent advances in tissue acquisition for molecular and histologic testing. Clinical lung cancer 2012;13:334-9. [PubMed]
- Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2013;8:823-59. [PubMed]
- Suda K, Tomizawa K, Mitsudomi T. Biological and clinical significance of KRAS mutations in lung cancer: an oncogenic driver that contrasts with EGFR mutation. Cancer Metastasis Rev 2010;29:49-60. [PubMed]
- Roberts PJ, Stinchcombe TE, Der CJ, et al. Personalized medicine in non-small-cell lung cancer: is KRAS a useful marker in selecting patients for epidermal growth factor receptor-targeted therapy? J Clin Oncol 2010;28:4769-77. [PubMed]
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011;223:219-29. [PubMed]
- Shigematsu H, Takahashi T, Nomura M, et al. Somatic mutations of the HER2 kinase domain in lung adenocarcinomas. Cancer Res 2005;65:1642-6. [PubMed]
- Buttitta F, Barassi F, Fresu G, et al. Mutational analysis of the HER2 gene in lung tumors from Caucasian patients: mutations are mainly present in adenocarcinomas with bronchioloalveolar features. Int J Cancer 2006;119:2586-91. [PubMed]
- Weiss J, Sos ML, Seidel D, et al. Frequent and focal FGFR1 amplification associates with therapeutically tractable FGFR1 dependency in squamous cell lung cancer. Sci Transl Med 2010;2:62ra93. [PubMed]
- Monica V, Scagliotti GV, Ceppi P, et al. Differential Thymidylate Synthase Expression in Different Variants of Large-Cell Carcinoma of the Lung. Clin Cancer Res 2009;15:7547-52. [PubMed]
- Ceppi P, Volante M, Saviozzi S, et al. Squamous cell carcinoma of the lung compared with other histotypes shows higher messenger RNA and protein levels for thymidylate synthase. Cancer 2006;107:1589-96. [PubMed]
- Nicolson MC, Fennell DA, Ferry D, et al. Thymidylate Synthase Expression and Outcome of Patients Receiving Pemetrexed for Advanced Nonsquamous Non-Small-Cell Lung Cancer in a Prospective Blinded Assessment Phase II Clinical Trial. J Thorac Oncol 2013;8:930-9. [PubMed]
- Socinski MA, Smit EF, Lorigan P, et al. Phase III study of pemetrexed plus carboplatin compared with etoposide plus carboplatin in chemotherapy-naive patients with extensive-stage small-cell lung cancer. J Clin Oncol 2009;27:4787-92. [PubMed]
- Olaussen KA, Dunant A, Fouret P, et al. DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy. N Engl J Med 2006;355:983-91. [PubMed]
- Custodio AB, Gonzalez-Larriba JL, Bobokova J, et al. Prognostic and predictive markers of benefit from adjuvant chemotherapy in early-stage non-small cell lung cancer. J Thorac Oncol 2009;4:891-910. [PubMed]
- Johnson DH, Fehrenbacher L, Novotny WF, et al. Randomized phase II trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non-small-cell lung cancer. J Clin Oncol 2004;22:2184-91. [PubMed]
- Maeshima AM, Maeshima A, Asamura H, et al. Histologic prognostic factors for small-sized squamous cell carcinomas of the peripheral lung. Lung Cancer 2006;52:53-8. [PubMed]
- Travis WD. Pathology of lung cancer. Clin Chest Med 2011;32:669-92. [PubMed]
- Cagle PT, Allen TC, Dacic S, et al. Revolution in lung cancer: new challenges for the surgical pathologist. Arch Pathol Lab Med 2011;135:110-6. [PubMed]
- Charloux A, Quoix E, Wolkove N, et al. The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma. Int J Epidemiol 1997;26:14-23. [PubMed]
- Yoshizawa A, Motoi N, Riely GJ, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases. Mod Pathol 2011;24:653-64. [PubMed]
- Miyoshi T, Satoh Y, Okumura S, et al. Early-stage lung adenocarcinomas with a micropapillary pattern, a distinct pathologic marker for a significantly poor prognosis. Am J Surg Pathol 2003;27:101-9. [PubMed]
- Tsutsumida H, Nomoto M, Goto M, et al. A micropapillary pattern is predictive of a poor prognosis in lung adenocarcinoma, and reduced surfactant apoprotein A expression in the micropapillary pattern is an excellent indicator of a poor prognosis. Mod Pathol 2007;20:638-47. [PubMed]
- Sica G, Yoshizawa A, Sima CS, et al. A grading system of lung adenocarcinomas based on histologic pattern is predictive of disease recurrence in stage I tumors. Am J Surg Pathol 2010;34:1155-62. [PubMed]
- Yoshizawa A, Sumiyoshi S, Sonobe M, et al. Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations: analysis of 440 Japanese patients. J Thorac Oncol 2013;8:52-61. [PubMed]
- Yanagawa N, Shiono S, Abiko M, et al. New IASLC/ATS/ERS classification and invasive tumor size are predictive of disease recurrence in stage I lung adenocarcinoma. J Thorac Oncol 2013;8:612-8. [PubMed]
- Russell PA, Wainer Z, Wright GM, et al. Does lung adenocarcinoma subtype predict patient survival?: A clinicopathologic study based on the new International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society international multidisciplinary lung adenocarcinoma classification. J Thorac Oncol 2011;6:1496-504. [PubMed]
- Howlader N NA, Krapcho M, Garshell J, et al. eds. SEER Cancer Statistics Review, 1975-2010, National Cancer Institute. Bethesda, MD, , based on November 2012 SEER data submission, posted to the SEER web site, April 2013.
- Sun Z, Aubry MC, Deschamps C, et al. Histologic grade is an independent prognostic factor for survival in non-small cell lung cancer: an analysis of 5018 hospital- and 712 population-based cases. J Thorac Cardiovasc Surg 2006;131:1014-20. [PubMed]
- Sawabata N, Asamura H, Goya T, et al. Japanese Lung Cancer Registry Study: first prospective enrollment of a large number of surgical and nonsurgical cases in 2002. J Thorac Oncol 2010;5:1369-75. [PubMed]
- Gustafsson BI, Kidd M, Chan A, et al. Bronchopulmonary neuroendocrine tumors. Cancer 2008;113:5-21. [PubMed]
- Rekhtman N. Neuroendocrine tumors of the lung: an update. Arch Pathol Lab Med 2010;134:1628-38. [PubMed]
- Australia AIoHaWC. Lung cancer in Australia: an overview. Canberra: AIHW2011. Report No.: Cancer series no. 64. Cat. no. CAN 58.
- Fan Z, Schraeder R. The changing pathology of lung cancer. Surg Oncol Clin N Am 2011;20:637-53. [PubMed]
- Travis WD, Brambilla E, Noguchi M, et al. Diagnosis of Lung Cancer in Small Biopsies and Cytology: Implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society Classification. Arch Pathol Lab Med 2013;137:668-84. [PubMed]
- Lack EE, Harris GB, Eraklis AJ, et al. Primary bronchial tumors in childhood. A clinicopathologic study of six cases. Cancer 1983;51:492-7. [PubMed]
- Fitzgibbons PL, Kern WH. Adenosquamous carcinoma of the lung: a clinical and pathologic study of seven cases. Hum Pathol 1985;16:463-6. [PubMed]
- Naunheim KS, Taylor JR, Skosey C, et al. Adenosquamous lung carcinoma: clinical characteristics, treatment, and prognosis. Ann Thorac Surg 1987;44:462-6. [PubMed]
- Ben Y, Yu H, Wang Z, et al. Adenosquamous lung carcinoma: clinical characteristics, surgical treament and prognosis. Chin Med Sci J 2000;15:238-40. [PubMed]
- Dacic S, Finkelstein SD, Sasatomi E, et al. Molecular pathogenesis of pulmonary carcinosarcoma as determined by microdissection-based allelotyping. Am J Surg Pathol 2002;26:510-6. [PubMed]
- Nappi O, Glasner SD, Swanson PE, et al. Biphasic and monophasic sarcomatoid carcinomas of the lung. A reappraisal of ‘carcinosarcomas’ and ‘spindle-cell carcinomas’. Am J Clin Pathol 1994;102:331-40. [PubMed]
- Thompson L, Chang B, Barsky SH. Monoclonal origins of malignant mixed tumors (carcinosarcomas). Evidence for a divergent histogenesis. Am J Surg Pathol 1996;20:277-85. [PubMed]
- Nakajima M, Kasai T, Hashimoto H, et al. Sarcomatoid carcinoma of the lung: a clinicopathologic study of 37 cases. Cancer 1999;86:608-16. [PubMed]
- Ro JY, Chen JL, Lee JS, et al. Sarcomatoid carcinoma of the lung. Immunohistochemical and ultrastructural studies of 14 cases. Cancer 1992;69:376-86. [PubMed]
- Travis WD. Sarcomatoid neoplasms of the lung and pleura. Arch Pathol Lab Med 2010;134:1645-58. [PubMed]
- Martini N, Melamed MR. Multiple primary lung cancers. J Thorac Cardiovasc Surg 1975;70:606-12. [PubMed]
- Huang J, Behrens C, Wistuba I, et al. Molecular analysis of synchronous and metachronous tumors of the lung: impact on management and prognosis. Ann Diagn Pathol 2001;5:321-9. [PubMed]
- Hiroshima K, Toyozaki T, Kohno H, et al. Synchronous and metachronous lung carcinomas: molecular evidence for multicentricity. Pathol Int 1998;48:869-76. [PubMed]
- Girard N, Deshpande C, Lau C, et al. Comprehensive histologic assessment helps to differentiate multiple lung primary nonsmall cell carcinomas from metastases. Am J Surg Pathol 2009;33:1752-64. [PubMed]
- Neugut AI, Sherr D, Robinson E, et al. Differences in histology between first and second primary lung cancer. Cancer Epidemiol Biomarkers Prev 1992;1:109-12. [PubMed]
- Inamura K, Satoh Y, Okumura S, et al. Pulmonary adenocarcinomas with enteric differentiation: histologic and immunohistochemical characteristics compared with metastatic colorectal cancers and usual pulmonary adenocarcinomas. Am J Surg Pathol 2005;29:660-5. [PubMed]
- Leong PP, Rezai B, Koch WM, et al. Distinguishing second primary tumors from lung metastases in patients with head and neck squamous cell carcinoma. J Natl Cancer Inst 1998;90:972-7. [PubMed]
- Geurts TW, Nederlof PM, van den Brekel MW, et al. Pulmonary squamous cell carcinoma following head and neck squamous cell carcinoma: metastasis or second primary? Clin Cancer Res 2005;11:6608-14. [PubMed]
- Day TA, Davis BK, Gillespie MB, et al. Oral cancer treatment. Curr Treat Options Oncol 2003;4:27-41. [PubMed]
- Keith RL, Miller YE. Lung cancer: genetics of risk and advances in chemoprevention. Curr Opin Pulm Med 2005;11:265-71. [PubMed]
- Pereira TC, Share SM, Magalhaes AV, et al. Can we tell the site of origin of metastatic squamous cell carcinoma? An immunohistochemical tissue microarray study of 194 cases. Appl Immunohistochem Mol Morphol 2011;19:10-4. [PubMed]
- Doxtader EE, Katzenstein AL. The relationship between p16 expression and high-risk human papillomavirus infection in squamous cell carcinomas from sites other than uterine cervix: a study of 137 cases. Hum Pathol 2012;43:327-32. [PubMed]
- Fong KM, Kida Y, Zimmerman PV, et al. Loss of heterozygosity frequently affects chromosome 17q in non-small cell lung cancer. Cancer Res 1995;55:4268-72. [PubMed]
- Klein F, Amin Kotb WF, Petersen I. Incidence of human papilloma virus in lung cancer. Lung Cancer 2009;65:13-8. [PubMed]
- Suo Z, Holm R, Nesland JM. Squamous cell carcinomas. An immunohistochemical study of cytokeratins and involucrin in primary and metastatic tumours. Histopathology 1993;23:45-54. [PubMed]
- Kaufmann O, Fietze E, Mengs J, et al. Value of p63 and cytokeratin 5/6 as immunohistochemical markers for the differential diagnosis of poorly differentiated and undifferentiated carcinomas. Am J Clin Pathol 2001;116:823-30. [PubMed]
- Sigel CS, Moreira AL, Travis WD, et al. Subtyping of non-small cell lung carcinoma: a comparison of small biopsy and cytology specimens. J Thorac Oncol 2011;6:1849-56. [PubMed]
- Rekhtman N, Ang DC, Sima CS, et al. Immunohistochemical algorithm for differentiation of lung adenocarcinoma and squamous cell carcinoma based on large series of whole-tissue sections with validation in small specimens. Mod Pathol 2011;24:1348-59. [PubMed]
- Righi L, Graziano P, Fornari A, et al. Immunohistochemical subtyping of nonsmall cell lung cancer not otherwise specified in fine-needle aspiration cytology: a retrospective study of 103 cases with surgical correlation. Cancer 2011;117:3416-23. [PubMed]
- Mukhopadhyay S. Utility of small biopsies for diagnosis of lung nodules: doing more with less. Mod Pathol 2012;25:S43-57. [PubMed]
- Bishop JA, Sharma R, Illei PB. Napsin A and thyroid transcription factor-1 expression in carcinomas of the lung, breast, pancreas, colon, kidney, thyroid, and malignant mesothelioma. Hum Pathol 2010;41:20-5. [PubMed]
- Nicholson AG, Gonzalez D, Shah P, et al. Refining the diagnosis and EGFR status of non-small cell lung carcinoma in biopsy and cytologic material, using a panel of mucin staining, TTF-1, cytokeratin 5/6, and P63, and EGFR mutation analysis. J Thorac Oncol 2010;5:436-41. [PubMed]
- Loo PS, Thomas SC, Nicolson MC, et al. Subtyping of undifferentiated non-small cell carcinomas in bronchial biopsy specimens. J Thorac Oncol 2010;5:442-7. [PubMed]
- Mukhopadhyay S, Katzenstein AL. Subclassification of non-small cell lung carcinomas lacking morphologic differentiation on biopsy specimens: Utility of an immunohistochemical panel containing TTF-1, napsin A, p63, and CK5/6. Am J Surg Pathol 2011;35:15-25. [PubMed]
- Chu P, Wu E, Weiss LM. Cytokeratin 7 and cytokeratin 20 expression in epithelial neoplasms: a survey of 435 cases. Mod Pathol 2000;13:962-72. [PubMed]
- Pelosi G, Rossi G, Cavazza A, et al. ΔNp63 (p40) Distribution Inside Lung Cancer: A Driver Biomarker Approach to Tumor Characterization. Int J Surg Pathol 2013;21:229-39. [PubMed]
- Candi E, Dinsdale D, Rufini A, et al. TAp63 and DeltaNp63 in cancer and epidermal development. Cell Cycle 2007;6:274-85. [PubMed]
- Bishop JA, Teruya-Feldstein J, Westra WH, et al. p40 (ΔNp63) is superior to p63 for the diagnosis of pulmonary squamous cell carcinoma. Mod Pathol 2012;25:405-15. [PubMed]
- Pelosi G, Fabbri A, Bianchi F, et al. ΔNp63 (p40) and thyroid transcription factor-1 immunoreactivity on small biopsies or cellblocks for typing non-small cell lung cancer: a novel two-hit, sparing-material approach. J Thorac Oncol 2012;7:281-90. [PubMed]
- Yang X, Lu H, Yan B, et al. ΔNp63 versatilely regulates a Broad NF-kappaB gene program and promotes squamous epithelial proliferation, migration, and inflammation. Cancer Res 2011;71:3688-700. [PubMed]
- Saintigny P, El-Naggar AK, Papadimitrakopoulou V, et al. DeltaNp63 overexpression, alone and in combination with other biomarkers, predicts the development of oral cancer in patients with leukoplakia. Clin Cancer Res 2009;15:6284-91. [PubMed]
- Alsharif M, Carlo-Demovich J, Massey C, et al. Telecytopathology for immediate evaluation of fine-needle aspiration specimens. Cancer Cytopathol 2010;118:119-26. [PubMed]
- Bulman W, Saqi A, Powell CA. Acquisition and processing of endobronchial ultrasound-guided transbronchial needle aspiration specimens in the era of targeted lung cancer chemotherapy. Am J Respir Crit Care Med 2012;185:606-11. [PubMed]
- Wallace WA, Rassl DM. Accuracy of cell typing in nonsmall cell lung cancer by EBUS/EUS-FNA cytological samples. Eur Respir J 2011;38:911-7. [PubMed]
- Layfield LJ, Bentz JS, Gopez EV. Immediate on-site interpretation of fine-needle aspiration smears: a cost and compensation analysis. Cancer 2001;93:319-22. [PubMed]
- Travis WD, Rekhtman N. Pathological diagnosis and classification of lung cancer in small biopsies and cytology: strategic management of tissue for molecular testing. Semin Respir Crit Care Med 2011;32:22-31. [PubMed]
- Thunnissen E, Kerr KM, Herth FJ, et al. The challenge of NSCLC diagnosis and predictive analysis on small samples. Practical approach of a working group. Lung cancer 2012;76:1-18. [PubMed]
- Ellison G, Zhu G, Moulis A, et al. EGFR mutation testing in lung cancer: a review of available methods and their use for analysis of tumour tissue and cytology samples. J Clin Pathol 2013;66:79-89. [PubMed]
(译者:岳君秋;校对:邵明海)
(本译文仅供学术交流,实际内容请以英文原文为准。)










