靶向治疗时代化疗在晚期非小细胞肺癌中的持续作用
靶向治疗时代化疗在晚期非小细胞肺癌中的持续作用
在过去的几年中,尽管非小细胞肺癌(NSCLC)的靶向治疗取得显著进展,化疗在晚期非小细胞肺癌患者的治疗中仍然至关重要。即使对于带有EGFR激活突变或ALK基因重组,并使用一线酪氨酸激酶抑制剂的患者,仍不可避免地发生药物耐受,因此化疗仍然是后续治疗的基础。在1 000例转移性肺腺癌患者的突变分析中,虽然肺癌突变联盟能够识别54%患者的可疑突变,包括与批准的药物和临床试验相关的分子畸变[1],但是仅约14~18%的西方人群,可用批准的靶向药物(EGFR和ALK TKIs)来治疗。到目前为止,尽管正在进行临床试验,尚未批准任何靶向致癌启动途径的药物用于鳞状细胞肺癌。对于未携带疑启动突变、又无对应的靶向药物能够有效改善预后的大多数晚期肺癌患者,通过合理联合用药以及发现新的有力的化疗药物,来改进化疗方案仍然至关重要。本文综述了近两年来晚期非小细胞肺癌化疗的进展。
晚期非小细胞肺癌一线化疗药物中铂类化合物的持续核心作用
虽然最近实施的治疗指南建议,带有EGFR活化突变或ALK基因重组的晚期非小细胞肺癌患者应分别使用厄洛替尼或克唑替尼作为一线药物,但是事实上,无论将EGFR TKI作为一线或二线药物,对于携带 EGFR突变的患者的总体生存并无益处。这种将TKI作为一线药物的建议甚至在肿瘤导致的身体状态较差的患者中也适用[2]。对于不带有致癌基因导致的肿瘤“合适的”患者,铂类化疗(包括使用贝伐单抗的非鳞癌患者)仍然是基础的治疗。为了保持疗效并减少毒性,有研究检测对比了非铂类新药物联用与传统以铂类为基础的药物联用的效果。尽管近期一项对16个随机试验的荟萃分析发现,三代非铂类药物联用与以铂类为基础的药物联用的疗效在总体生存期方面相当(HR 1.03;95% CI: 0.98-1.08;P=0.290)[3],但是所有基于指南的证据都支持以铂类为基础的化疗是治疗的标准。通过对不同非铂类方案的亚组分析发现:与以铂类为基础的化疗方案相比,所有非铂类化疗方案的生存率并无差别。汇总无进展生存期表明,含铂方案可能优于非铂类方案(HR 1.06;95% CI:1.01-1.12;P=0.03),在此研究中,关于毒性的荟萃分析无法进行。
为了试图表明铂类化合物是非必要的,最近一项Ⅲ期临床试验让体力评分为2的晚期非小细胞肺癌患者随机接受培美曲塞联合或不联合卡铂治疗,所有疗效参数均表明卡铂-培美曲塞联合的疗效优于单独使用培美曲塞者:反应率23.8% vs. 10.3%,无进展生存期 5.8个月 vs. 2.8个月,总生存期 9.3个月 vs. 5.3个月[4]。显然,所有类型的无EGFR突变或者ALK融合的晚期非小细胞肺癌患者的有力证据都支持含铂化疗方案。
选择含铂和非含铂化疗的生物标志物
利用DNA修复酶来更好地选择一线化疗的生物标志物是研究领域的热点。初步研究已证实:IHC或RT-PCR检测到的ERCC1的低表达是含铂方案有益的一个潜在的生物标志物,而RRM1低表达是吉西他滨有益的潜在生物标志物。ERCC1酶去除铂诱导的DNA加合物,因此低水平的ERCC1与铂类敏感性相关[5];RRM1是核糖核苷酸还原酶的一个亚基,它是吉西他滨的主要靶点,因此,RRM1低水平与吉西他滨的敏感性相关[6]。在最近公布的Ⅲ期TASTE 试验中,转移性非小细胞肺癌患者被按照2∶1的比例随机分配到实验组:①吉西他滨/卡铂组,若RRM1和ERCC1均低;②多西紫杉醇/卡铂,RRM1高而ERCC1低;③吉西他滨/多西紫杉醇,RRM1低而ERCC1高;④多西紫杉醇/长春瑞滨,两者均高[7]。对照组患者接受吉西他滨/卡铂,四组患者的无进展生存期或总体生存期均无统计学差异。作者注意到,他们需要及时处理肿瘤标本进行ERCC1、RRM1和原位蛋白水平的检测,因此,试剂检测的可靠性和处理程序的日间变化可能会影响到检测方法的可靠性和可重复性。最近的一项试图使用IHC验证ERCC1可作为含铂方案化疗的预后标志物的尝试失败了,原因是ERCC1不同批次的相同抗体不能检测ERCC1同工型[8]。
胸苷酸是DNA从头合成途径的源头,胸苷酸合成酶(TS)是DNA复制和细胞生长所必需的酶,也是培美曲塞的主要靶点之一。培美曲塞具有潜在的组织特异性优势,这可能与肺鳞癌中TS高表达有关,相比而言腺癌过度表达TS,培美曲塞的敏感性则降低[9]。在体外研究中,不同表达程度的TS与培美曲塞敏感性有关[10]。一项迄今为止报道的最大的对生物标志物的基因表达进行的数据集分析显示ERCC1、RRM1和TS的重要组织学关联已显而易见,它们成为评估这些化疗相关标志物的预测价值的随机Ⅲ期试验的根据[11]。
另一种可能有助于化疗选择的标志物是SPARC(富含半胱氨酸的酸性分泌蛋白),由肿瘤和/或邻近的间质产生的一种基质细胞糖蛋白。SPARC的表达被认为能促进细胞内结合紫杉醇的白蛋白纳米粒(nab-紫杉醇)的累积[12]。实验研发中、标准化、组织处理和抗体可靠性中的多个问题,影响标志物在晚期非小细胞肺癌中更合理地选择化疗方案联用的潜在应用。这些预测性的标志物的进一步发展对治疗方案从化疗转向靶向化疗意义重大。
非鳞癌的培美曲塞一线治疗
培美曲塞是一种多靶点抗叶酸药物:可与铂类衍生物一同用于一线治疗、单一药物用于后续化疗,也可作为维持治疗。在一项具有里程碑意义的JMDB试验中,Scagliotti等人证实顺铂/吉西他滨和顺铂/培美曲塞作为一线方案治疗转移性非小细胞肺癌患者的总生存期无差异。然而,在预先计划的亚组分析中,非鳞癌组的顺铂-培美曲塞联用优于顺铂-吉西他滨联用,前者的中位总生存期为12.6个月,后者为10.9个月(HR 0.84;95%CI:0.71-0.99;P=0.03)[13];相比之下,接受顺铂-培美曲塞联用的鳞癌患者的中位总生存期差于顺铂-吉西他滨组(9.4个月 vs. 10.8个月;HR 1.23;95%CI:1.0-1.5;P= 0.05)。
最近,挪威的肺癌研究小组进行了一项入组436名患者的研究,比较以卡铂-培美曲塞和卡铂-吉西他滨作为一线治疗的晚期非小细胞肺癌患者的健康相关生活质量(HRQol)。两种方案治疗的患者在健康相关生活质量和总体生存期方面的结果类似(卡铂-吉西他滨组为7.3个月,卡铂-培美曲塞组为7.0个月;P= 0.63)[14]。多因素分析和交互测试未见组织类型和生存期有显著关联,与JMDB试验不同,卡铂-培美曲塞联用对于非鳞癌没有更好的效果 。在另一个随机Ⅲ期试验中,与卡铂-多西他赛相比,卡铂-培美曲塞组的晚期非鳞状非小细胞肺癌患者获得了更长的中位生存期(3.2个月vs. 0.7个月;HR 0.45;95% CI:0.34-0.61),未出现毒性反应。无毒性生存期的初始终点的定义是从随机时间到第一次治疗诱导3~4级不良事件之间的间隔[15]。在2012年发表的一项荟萃分析中,李和他的同事们评估了临床试验方案的选择,比较基于铂类联合应用培美曲塞和基于铂类联合应用其他第三代药物作为一线治疗方案的疗效。培美曲塞组获得了一致的生存期优势,尤其对于非鳞状非小细胞肺癌患者(占患者的大多数)[16]。五项试验(三项一线试验,一项二线试验,一项维持试验)的荟萃分析证实:与替代疗法或安慰剂相比,培美曲塞总是与非鳞癌患者的总体生存期显著改善相关(HR 0.82),而鳞癌患者则非如此(HR 1.19)[17]。
使用靶向药物联合化疗
转移性的非小细胞肺癌的诊断和管理模式已经转变为:将是否存在致癌基因缺陷作为选择合理治疗方案的关键分支点。如上所述,对于EGFR、ALK启动子突变的患者,EGFR-TKIs和克唑替尼正逐渐替代传统化疗,成为首选治疗方法[18]。但是,起初TKI敏感者由于获得性耐药不可避免地会产生耐受性。近来,新出现的与患者本身肿瘤异质性相关的复杂现象已经受到关注,特别是从原发性肿瘤到转移性肿瘤、不同部位肿瘤治疗的混合反应、导致体细胞突变的克隆变化[2]等,同时,联合化疗对于转移性癌症的治疗已进入停滞期[19]。因此,新的焦点就聚集在将新的靶向药物与化疗结合以取得最佳疗效,提高存活率,以及克服获得性耐药。先前的研究在未经选择的人群中联用EGFR抑制剂与现有化疗药物,结果生存率未见改善[20]。
考虑到未经选择的患者联用当前化疗药物和EGFR TKIs未见明显获益,最佳联合化疗和TKI方案的努力仍在进行。一种途径是依据临床前原理在化疗中插入使用TKI,原因是EGFR TKIs能诱导G1细胞周期阻断,因而抑制了化疗引起的细胞周期依赖性细胞毒效应[21]。因为EGFR-TKIs的作用机制理论上可干扰甚至拮抗化疗的作用,所以推测采用连续或间断的给药方式,使得两者药效分离可能会获得较好的效果[18]。
表1列出了近两年联合化疗与靶向药物或者新的小分子抑制剂的Ⅲ期试验的结果。治疗法则包括单靶向药物、多靶向药物,两者同时进行、插入式化疗以及维持治疗。
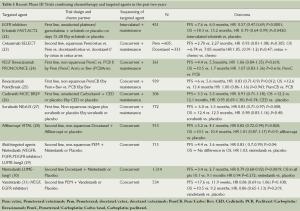
Full table
最近发表的FASTACT-2研究显示,插入埃罗替尼和化疗可以改善富含EGFR活化突变的东亚患者的无进展生存期和总体生存期。但是在EGFR野生型患者中,无进展生存期和总体生存期均无显著差别[22]。治疗显著获益的是那些肿瘤中含有EGFR活性突变的患者(中位无进展生存期16.8个月vs. 6.9个月;HR 0.25;P<0.0001;中位总体生存期31.4个月vs. 2 0.6个月,HR 0.48;P=0.0092)。
一项Ⅲ期试验中,抗VEGF单克隆抗体贝伐单抗已被证实联用卡铂和紫杉醇可使总体生存期改善,这种联用在非鳞状非小细胞肺癌的治疗中可作为一个选择。然而,自2000年以来,超过11个其他Ⅲ期试验显示,在使用贝伐单抗或者其他抗血管生成药物联合铂类化疗时,总体生存期未见改善。抗血管生成疗法的一个重要问题是缺乏疗效预测标志物。考虑到目前二三线治疗等有效药物的多样性,无进展生存期和总体生存期改善的差异也可能受进一步治疗的影响。
一项近期PRONOUCE研究的主要目的是:在没有4级毒性的情况下,比较两药方案(培美曲塞/卡铂)和三药方案(紫杉醇/卡铂+贝伐单抗)在Ⅲ期优越性试验中的无进展生存期[24]。这种试验设计的原则存在疑问。尽管如此,研究结果为阴性。在PointBreak试验中,患者被随机分配到卡铂/紫杉醇/贝伐单抗组,续以用贝伐单抗维持治疗;另一组是卡铂/培美曲塞/贝伐单抗,续以用培美曲塞/贝伐单抗维持治疗[25]。在所有年龄组中均未见总体生存期存在差别。事实上,紫杉醇对于总体生存期在数值上存在优势。
Nintedanib是一种新的多靶向口服抑制剂,它对于VEGFR、FGFR和PDGFR均有抑制作用,该药物与化疗联用可以延长无进展生存期[29,30]。其他探究性实验显示了该药联用化疗的早期信号,联用化疗包括联合免疫疗法如联用Ipillumumab、PD-L1或联用伴侣蛋白如Hsp90的抑制剂Ganetespib[32-34]。
总之,联用化疗和靶向治疗的最佳方案仍不清楚。此外,这些实验强调,无论被评价的为何种治疗方案,患者的选择可能会影响实验结果。
晚期非小细胞肺癌的维持治疗
改善患者预后的维持治疗策略是非小细胞肺癌的热门研究领域,持续和转换维持途径的研究都很活跃。持续维持策略希望在标准一线化疗的4个周期之后抑制肿瘤生长。另外,转换维持策略希望通过联用不同机制的化疗药物来延迟对治疗的耐药性。总的来说,维持治疗的目标不仅仅是延长无进展生存期,而是在不降低生活质量的情况下,延长总体生存期。
近期发表的最著名的关于维持化疗的研究报告是PARAMOUNT。在这个大型Ⅲ期临床试验中,非鳞状非小细胞肺癌患者在接受4个周期的顺铂/培美曲塞化疗后,随机接受培美曲塞或安慰剂治疗,同时给予最佳的维持治疗。使用培美曲塞持续维持治疗患者的无进展生存期(HR 0.62, P<0.0001)和总生存期 (HR 0.78, P=0.019)均显著延长[35,36]。由于毒性导致培美曲塞维持治疗中止也较少(5%)。两组中有相当数量的患者接受了中止后治疗(64%的安慰剂治疗组患者,58%的培美曲塞维持治疗患者)。然而,维持治疗的费用相当昂贵。最近,中国的一项成本效益分析预计,中国卫生保障系统中每质量调整生命年培美曲塞维持化疗的支出在125 000~180 000美元[37]。此外,对于非鳞癌患者,目前仍不清楚,及时进行二线治疗或者肿瘤恶化后重新使用培美曲塞治疗,是否能取得与培美曲塞维持治疗相同的疗效,尤其是对于那些最初受益于一线铂类/培美曲塞双重治疗, 后期又未维持治疗的患者。最后,还存在两个相当大的争论,即4周期的诱导化疗对于考虑维持治疗是否充分,还有就是进一步诱导治疗是否能够使中位无进展生存期延长2个月。
在另一项培美曲塞维持试验(JMEN)中使用了转换维护策略,总体生存期得到提高,患者生活质量与安慰剂组类似,仅出现轻微的食欲下降或咯血、疼痛恶化延迟[38]。但是,本实验结果存在混淆,因为安慰剂组中存在非常少的二线药物与培美曲塞交叉,使得实际结果的解释变得困难。其他试验中,在一线化疗后使用吉西他滨和多西他赛维持治疗与肿瘤恶化后开始治疗相比,均未表现出总体生存期获益[39,40]。对很多维持试验的批评在于:对于被分到最佳支持组的患者,肿瘤恶化后大部分患者未能接受二线治疗。一些维持治疗试验的亚组分析表明,病情稳定的患者可能会受益更多,而那些对治疗敏感者则非如此。虽然只是假说,但也是有根据的:治疗不敏感的患者恶化可能更快,通常会接受早期二线药物治疗。因此,无论怎么说,转而使用多西紫杉醇或吉西他滨可被视作二线治疗,而不是维持治疗,尤其是对于一线治疗有反应的功能状态良好的鳞癌患者。
新的化疗药物
白蛋白结合型紫杉醇
紫杉烷类药物作为非小细胞肺癌治疗的主要药物已经有超过10年的历史。130纳米的白蛋白结合型紫杉醇(nab-紫杉醇)与标准紫杉醇(sb-紫杉醇)不同,它可以通过小窝蛋白介导的胞吞转运优先被肿瘤细胞摄取。提高药物传递效率的机制是将白蛋白与SPARC(一种分泌蛋白、酸性、富含半胱氨酸)连接,与正常组织相比,SPARC在肿瘤细胞中表达丰富[41]。它不含辅料聚氧乙烯蓖麻油,而标准结合型紫杉醇含有该辅料,可以引发过敏。一项大型随机Ⅲ期临床试验,研究白蛋白紫杉醇联合卡铂和标准紫杉醇联合卡铂作为一线化疗方案治疗转移性非小细胞肺癌的疗效。该试验达到增加白蛋白紫杉醇联合卡铂敏感率的初步目标(33% vs. 25%,P=0.005)[42]。鳞状细胞癌患者敏感率增加幅度最大(41% vs. 24%),非鳞癌患者整体反应率未见增加。与标准紫杉醇联用组相比,白蛋白紫杉醇组3级以上神经病变也较少。但是,总体或无进展生存期并没有明显改善。在一项亚组分析中,来自北美的70岁以上患者使用白蛋白结合型紫杉醇后,总体生存期显著增加,但是这个亚组分析应仅考虑为一种假设。对于基础神经病变患者或对蓖麻油过敏的患者,白蛋白结合型紫杉醇显然是标准紫杉醇合适的替代品。此外,对于需要增加敏感性的鳞癌患者,可以优选白蛋白结合型紫杉醇。非小细胞肺癌中鳞癌患者的新治疗方案已远远落后于肺腺癌患者的治疗方案,这一现实也支持这一理论。
卡巴他赛
卡巴他赛是另一种紫杉烷类药物,目前已进入晚期非小细胞肺癌Ⅱ期临床试验(NCT01438307)。最近的研究数据显示该药可使转移性前列腺癌患者的总体生存期延长,这成为了在非小细胞肺癌中评估该药物价值的基础[43],但是,卡他巴塞在转移性非小细胞肺癌的试验结果尚不成熟。
Vintafolide(EC145):叶酸—长春花生物碱结合物
长春花生物碱已被证明在非小细胞肺癌有活性,但在非小细胞肺癌的一线或二线系统治疗中,很大程度上被紫杉烷类和培美曲塞取代。Vintafolide是叶酸分子和长春碱的结合物。超过75%的非小细胞肺癌是叶酸受体阳性(免疫组化),这就提示了叶酸受体靶向治疗的可能性。在最近的一项Ⅱ期临床试验中,通过99tc-EC20 CT扫描协同成像选择表达叶酸受体的肿瘤患者,从而让这些患者接受Vintafolide治疗。因此,EC20摄取正在发展成为Vintafolide治疗的潜在预测标志物。在一项Ⅱ期临床试验中,在EC20扫描阳性的多次化疗后复发/难治性非小细胞肺癌患者中,有26%的患者临床获益(病情稳定+总体敏感率)[44]。目前,vintafolide联合多西紫杉醇治疗复发/难治性非小细胞肺癌患者(NCT01577654)的随机Ⅱ期临床试验正在进行。
甲磺酸艾日布林
甲磺酸艾日布林是从一种罕见的海洋海绵中分离的halichondron B的人工合成类似物。它能通过有别于紫杉烷类或长春花生物碱的独特机制抑制微管动力。甲磺酸艾日布林最近被批准用于乳腺癌,试验显示,该药物可提高已接受蒽环类和紫杉类多次化疗的转移性乳腺癌患者的总体生存期[45]。在一项Ⅱ期临床试验中,此前接受紫杉烷类的非小细胞肺癌患者对甲磺酸艾日布林敏感率低(5%),但50%的患者病情稳定[46]。甲磺酸艾日布林联合厄洛替尼(NCT01104155)、培美曲塞(NCT01126736)或医生选择对照药物(NCT01454934)的3个独立临床试验正在进行。
伊沙匹隆
伊沙匹隆是一种称作epithilone类的药物(一种新型抗微管药物)类似于紫杉烷类化合物,它能够结合并稳定微管,最终导致G2/M期细胞周期阻滞。一些临床前研究表明伊沙匹隆在紫杉类耐药模型中有效,该药已被批准用于治疗转移性乳腺癌。在一项非小细胞肺癌的随机Ⅱ期临床试验中,伊沙匹隆并没有改善总体生存期或取得任何有意义的临床疗效[47]。研究者根据患者β3-微管蛋白的免疫组化结果分类患者,表明其是一个负性预后指标,而不是伊沙匹隆受益的预测指标。由于没有明确的证据表明伊沙匹隆比紫杉醇更优越,该药在晚期非小细胞治疗中的发展前景尚不清楚。
普拉曲沙
普拉曲沙是靶向二氢叶酸还原酶的一种叶酸类似物,近期的一项随机Ⅱ期临床试验,即在一线化疗后恶化的转移性非小细胞肺癌患者中比较普拉曲沙与厄洛替尼的疗效,结果显示它们的总体生存期与无进展生存期均有延长趋势[48]。本研究中普拉曲沙治疗的100位患者中,有18位患者之前接受过培美曲赛治疗。尽管已经补充维生素B12和叶酸,仍有很高比例的患者发生普拉曲沙相关的黏膜炎。由于培美曲塞越来越多地被纳入非鳞状非小细胞肺癌的前期治疗方案,而普拉曲沙的毒性又较大,额外的抗叶酸治疗的地位前途未卜。
新化疗药物总结
正在进行临床开发或最近已评估多种新型化疗药物在非小细胞肺癌中的应用(表2)。其中一些药物是源自那些已证明对非小细胞肺癌有效的药物类似物(如卡巴他赛,普拉曲沙),而另外一些已被证实可以优先靶向作用于肿瘤细胞(如白蛋白结合型紫杉醇,vintafolide)。伊沙匹隆和甲磺酸艾日布林与紫杉烷类相比,通过不同的作用机制影响微管动力。迄今为止,没有任何一项临床实验显示这些药物对于晚期非小细胞肺癌患者有显著疗效,但一些新的药物可能在特殊的治疗方案中发挥其作用,如上面所讨论的白蛋白结合型紫杉醇。
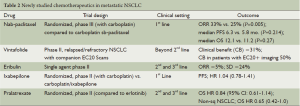
Full table
讨论
考虑到目前确定为致癌基因导致癌症、可以治愈的患者亚群仍较稀少,化疗对绝大多数晚期非小细胞肺癌患者来说仍是不可或缺的选择。一些新的非小细胞肺癌化疗药物正在临床研究阶段,尽管它们在实际治疗中的作用还有待确定。我们试图分级、排序和合理联用现有的化疗方法以得到最佳的治疗效果,已经出现一些可喜的结果。转换和持续维持策略是有利的,但是精确界定哪些患者适合这种治疗还是一个问题,因为实验设计并不能完全反映现实中的具体情况。维持疗法的某些方面还需进一步的验证,包括诱导化疗的最佳疗程数、治疗间隔期的作用、生活质量和经济状况,以及肿瘤参数设置中无进展生存期是否能作为一个有价值的治疗指标[49]。近几十年来,以铂类为基础的细胞毒性化疗已成为非小细胞肺癌治疗的支柱,而无铂治疗方案并未显示出优势。至今为止,方法学问题一直制约着DNA修复标志物或其他化疗标志物的发展。因此,联合化疗与靶向治疗的最佳策略是具有发展前景的热点研究领域。
尽管过去几年非小细胞肺癌的靶向治疗已取得显著成果,但是化疗在晚期非小细胞肺癌的治疗中依然起着至关重要的作用。
Acknowledgements
Disclosure: The authors declare no conflict of interest.
References
- Kris MG, Johnson BE, Kwiatkowski DJ, et al. Identification of driver mutations in tumor specimens from 1,000 patients with lung adenocarcinoma: the NCI’s Lung Cancer Mutation Consortium (LCMC). J Clin Oncol 2011;29:abstr CRA7506.
- Li T, Kung HJ, Mack PC, et al. Genotyping and genomic profiling of non-small-cell lung cancer: implications for current and future therapies. J Clin Oncol 2013;31:1039-49. [PubMed]
- Jiang J, Liang X, Zhou X, et al. Non-platinum doublets were as effective as platinum-based doublets for chemotherapy-naïve advanced non-small-cell lung cancer in the era of third-generation agents. J Cancer Res Clin Oncol 2013;139:25-38. [PubMed]
- Zukin M, Barrios CH, Rodrigues Pereira J, et al. Randomized Phase III Trial of Single-Agent Pemetrexed Versus Carboplatin and Pemetrexed in Patients With Advanced Non-Small-Cell Lung Cancer and Eastern Cooperative Oncology Group Performance Status of 2. J Clin Oncol 2013;31:2849-53. [PubMed]
- Altaha R, Liang X, Yu JJ, et al. Excision repair cross complementing-group 1: gene expression and platinum resistance. Int J Mol Med 2004;14:959-70. [PubMed]
- Bepler G, Kusmartseva I, Sharma S, et al. RRM1 modulated in vitro and in vivo efficacy of gemcitabine and platinum in non-small-cell lung cancer. J Clin Oncol 2006;24:4731-7. [PubMed]
- Bepler G, Williams C, Schell MJ, et al. Randomized International Phase III Trial of ERCC1 and RRM1 Expression-Based Chemotherapy Versus Gemcitabine/Carboplatin in Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2013;31:2404-12. [PubMed]
- Friboulet L, Olaussen KA, Pignon JP, et al. ERCC1 isoform expression and DNA repair in non-small-cell lung cancer. N Engl J Med 2013;368:1101-10. [PubMed]
- Sigmond J, Backus HH, Wouters D, et al. Induction of resistance to the multitargeted antifolate Pemetrexed (ALIMTA) in WiDr human colon cancer cells is associated with thymidylate synthase overexpression. Biochem Pharmacol 2003;66:431-8. [PubMed]
- Giovannetti E, Mey V, Nannizzi S, et al. Cellular and pharmacogenetics foundation of synergistic interaction of pemetrexed and gemcitabine in human non-small-cell lung cancer cells. Mol Pharmacol 2005;68:110-8. [PubMed]
- Maus MK, Mack PC, Astrow SH, et al. Histology-related associations of ERCC1, RRM1, and TS biomarkers in patients with non-small-cell lung cancer: implications for therapy. J Thorac Oncol 2013;8:582-6. [PubMed]
- Shao H, Tang H, Salavaggione OE, et al. Improved response to nab-paclitaxel compared with cremophor-solubilized paclitaxel is independent of secreted protein acidic and rich in cysteine expression in non-small cell lung cancer. J Thorac Oncol 2011;6:998-1005. [PubMed]
- Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008;26:3543-51. [PubMed]
- Grønberg BH, Bremnes RM, Fløtten O, et al. Phase III study by the Norwegian lung cancer study group: pemetrexed plus carboplatin compared with gemcitabine plus carboplatin as first-line chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2009;27:3217-24. [PubMed]
- Rodrigues-Pereira J, Kim JH, Magallanes M, et al. A randomized phase 3 trial comparing pemetrexed/carboplatin and docetaxel/carboplatin as first-line treatment for advanced, nonsquamous non-small cell lung cancer. J Thorac Oncol 2011;6:1907-14. [PubMed]
- Li M, Zhang Q, Fu P, et al. Pemetrexed plus platinum as the first-line treatment option for advanced non-small cell lung cancer: a meta-analysis of randomized controlled trials. PLoS One 2012;7:e37229. [PubMed]
- Al-Saleh K, Quinton C, Ellis PM. Role of pemetrexed in advanced non-small-cell lung cancer: meta-analysis of randomized controlled trials, with histology subgroup analysis. Curr Oncol 2012;19:e9-e15. [PubMed]
- Pennell NA. Integration of EGFR inhibitors and conventional chemotherapy in the treatment of non-small-cell lung cancer. Clin Lung Cancer 2011;12:350-9. [PubMed]
- Belani CP, Goss G, Blumenschein G Jr. Recent clinical developments and rationale for combining targeted agents in non-small cell lung cancer (NSCLC). Cancer Treat Rev 2012;38:173-84. [PubMed]
- Herbst RS, Prager D, Hermann R, et al. TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2005;23:5892-9. [PubMed]
- Gandara DR, Gumerlock PH. Epidermal growth factor receptor tyrosine kinase inhibitors plus chemotherapy: case closed or is the jury still out? J Clin Oncol 2005;23:5856-8. [PubMed]
- Wu YL, Lee JS, Thongprasert S, et al. Intercalated combination of chemotherapy and erlotinib for patients with advanced stage non-small-cell lung cancer (FASTACT-2): a randomised, double-blind trial. Lancet Oncol 2013;14:777-86. [PubMed]
- Kim ES, Neubauer MA, Cohn AL, et al. SELECT: Randomized phase III study of docetaxel (D) or pemetrexed (P) with or without cetuximab (C) in recurrent or progressive non-small cell lung cancer (NSCLC) after platinum-based therapy. J Clin Oncol 2012;30:abstr 7502.
- Zinner R, Ross HJ, Weaver R, et al. Randomized, open-label, phase III study of pemetrexed plus carboplatin (PemC) followed by maintenance pemetrexed versus paclitaxel/carboplatin/bevacizumab (PCB) followed by maintenance bevacizumab in patients with advanced nonsquamous (NS) non-small cell lung cancer (NSCLC). J Clin Oncol 2013;31:abstr LBA8003.
- Socinski MA, Patel JD, Garon EB, et al. A phase III study of pemetrexed (Pem) plus carboplatin (Cb) plus bevacizumab (Bev) followed by maintenance pem plus bev versus paclitaxel (Pac) plus cb plus bev followed by maintenance bev in stage IIIb or IV nonsquamous non-small cell lung cancer (NS-NSCLC): overall and age group results. J Clin Oncol 2013;31:abstr 8004.
- Laurie SA, Solomon BJ, Seymour L, et al. A randomized double-blind trial of carboplatin plus paclitaxel (CP) with daily oral cediranib (CED), an inhibitor of vascular endothelial growth factor receptors, or placebo (PLA) in patients (pts) with previously untreated advanced non-small cell lung cancer (NSCLC): NCIC Clinical Trials Group study BR29. J Clin Oncol 2012;30:abstr 7511.
- Paz-Ares LG, Biesma B, Heigener D, et al. Phase III, randomized, double-blind, placebo-controlled trial of gemcitabine/cisplatin alone or with sorafenib for the first-line treatment of advanced, nonsquamous non-small-cell lung cancer. J Clin Oncol 2012;30:3084-92. [PubMed]
- Ramlau R, Gorbunova V, Ciuleanu TE, et al. Aflibercept and Docetaxel versus Docetaxel alone after platinum failure in patients with advanced or metastatic non-small-cell lung cancer: a randomized, controlled phase III trial. J Clin Oncol 2012;30:3640-7. [PubMed]
- Hanna NH, Kaiser R, Sullivan RN, et al. Lume-lung 2: a multicenter, randomized, double-blind, phase III study of nintedanib plus pemetrexed versus placebo plus pemetrexed in patients with advanced nonsquamous non-small cell lung cancer (NSCLC) after failure of first-line chemotherapy. J Clin Oncol 2013;31:abstr 8034.
- Reck M, Kaiser R, Mellemgaard A, et al. Nintedanib (BIBF 1120) plus docetaxel in NSCLC patients progressing after first-line chemotherapy: LUME Lung 1, a randomized, double-blind phase III tria. J Clin Oncol 2013;31:abstr LBA8011.
- de Boer RH, Arrieta Ó, Yang CH, et al. Vandetanib plus pemetrexed for the second-line treatment of advanced non-small-cell lung cancer: a randomized, double-blind phase III trial. J Clin Oncol 2011;29:1067-74. [PubMed]
- Tomasini P, Khobta N, Greillier L, et al. Ipilimumab: its potential in non-small cell lung cancer. Ther Adv Med Oncol 2012;4:43-50. [PubMed]
- Fennell DA, Goss DG, Socinski MA, et al. GALAXY-2 trial: a randomized phase III study of ganetespib in combination with docetaxel versus docetaxel alone in patients with advanced non-small cell lung adenocarcinoma. J Clin Oncol 2013;31:abstr TPS8126.
- Spigel DR, S NG, Horn L, et al. Clinical activity, safety, and biomarkers of MPDL3280A, an engineered PD-L1 antibody in patients with locally advanced or metastatic non-small cell lung cancer (NSCLC). J Clin Oncol 2013;31:abstr 8008.
- Paz-Ares L, de Marinis F, Dediu M, et al. Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non-squamous non-small-cell lung cancer (PARAMOUNT): a double-blind, phase 3, randomised controlled trial. Lancet Oncol 2012;13:247-55. [PubMed]
- Paz-Ares L, F DM, Dediu M, et al. PARAMOUNT: Final overall survival (OS) results of the phase III study of maintenance pemetrexed (pem) plus best supportive care (BSC) versus placebo (plb) plus BSC immediately following induction treatment with pem plus cisplatin (cis) for advanced nonsquamous (NS) non-small cell lung cancer (NSCLC). J Clin Oncol 2012;30:abstr LBA7507.
- Zeng X, Peng L, Li J, et al. Cost-effectiveness of continuation maintenance pemetrexed after cisplatin and pemetrexed chemotherapy for advanced nonsquamous non-small-cell lung cancer: estimates from the perspective of the Chinese health care system. Clin Ther 2013;35:54-65. [PubMed]
- Belani CP, Brodowicz T, Ciuleanu TE, et al. Quality of life in patients with advanced non-small-cell lung cancer given maintenance treatment with pemetrexed versus placebo (H3E-MC-JMEN): results from a randomised, double-blind, phase 3 study. Lancet Oncol 2012;13:292-9. [PubMed]
- Fidias PM, Dakhil SR, Lyss AP, et al. Phase III study of immediate compared with delayed docetaxel after front-line therapy with gemcitabine plus carboplatin in advanced non-small-cell lung cancer. J Clin Oncol 2009;27:591-8. [PubMed]
- Belani CP, Waterhouse DM, Ghazal H, et al. Phase III study of maintenance gemcitabine (G) and best supportive care (BSC) versus BSC, following standard combination therapy with gemcitabine-carboplatin (G-Cb) for patients with advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2010;28:15:abstr 7506
- Gradishar WJ. Albumin-bound paclitaxel: a next-generation taxane. Expert Opin Pharmacother 2006;7:1041-53. [PubMed]
- Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase III trial. J Clin Oncol 2012;30:2055-62. [PubMed]
- de Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010;376:1147-54. [PubMed]
- Edelman MJ, Harb WA, Pal SE, et al. Multicenter trial of EC145 in advanced, folate-receptor positive adenocarcinoma of the lung. J Thorac Oncol 2012;7:1618-21. [PubMed]
- Cortes J, O’Shaughnessy J, Loesch D, et al. Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. Lancet 2011;377:914-23. [PubMed]
- Gitlitz BJ, Tsao-Wei DD, Groshen S, et al. A phase II study of halichondrin B analog eribulin mesylate (E7389) in patients with advanced non-small cell lung cancer previously treated with a taxane: a California cancer consortium trial. J Thorac Oncol 2012;7:574-8. [PubMed]
- Edelman MJ, Schneider CP, Tsai CM, et al. Randomized phase II study of ixabepilone or paclitaxel plus carboplatin in patients with non-small-cell lung cancer prospectively stratified by beta-3 tubulin status. J Clin Oncol 2013;31:1990-6. [PubMed]
- Kelly K, Azzoli CG, Zatloukal P, et al. Randomized phase 2b study of pralatrexate versus erlotinib in patients with stage IIIB/IV non-small-cell lung cancer (NSCLC) after failure of prior platinum-based therapy. J Thorac Oncol 2012;7:1041-8. [PubMed]
- Gerber DE, Schiller JH. Maintenance chemotherapy for advanced non-small-cell lung cancer: new life for an old idea. J Clin Oncol 2013;31:1009-20. [PubMed]
(译者:韩月;校对:串俊兰)
(本译文仅供学术交流,实际内容请以英文原文为准。)


