胸腔镜肺叶切除术有利于非小细胞肺癌患者术后多西他赛/卡铂辅助化疗的实施
引言
新的治疗方法不断出现并竞争临床资源。一种新的癌症治疗方法能否接受评估以及应用于医疗服务资源不足的人群,在很大程度上取决于进入中期后期阶段临床试验时招募患者的速度。对于许多种癌症,包括非小细胞肺癌(non-small cell lung cancer,NSCLC),临床试验入组速度在传统上一直比较慢,许多试验需要数年才能完成患者的招募入组,甚至有的研究在获得目标样本量前就关闭入组而影响结果的统计效能[1]。这个问题在术后的辅助治疗方面的临床研究尤为明显。中国临床试验协会(China Clinical Trials Consortium, CCTC)是为了开展先进的临床研究而在中国建立的一个协作组,以快速、高效、严谨的态度招募大量的癌症患者参与针对肿瘤治疗新方法的临床研究。
与许多其他癌症相比,即使发现时是早期,非小细胞肺癌患者的总体生存仍然比较差[2]。即使ⅠA期患者接受根治性切除术后5年生存率只有70%~75%[3,4],Ⅱ~ⅢA期患者手术后5年生存率仅为30%~50%[4]。在早期就有无法检测到的微转移,成为了大多数局部治疗术后复发的原因。因此,非小细胞肺癌的术后辅助全身治疗被广泛研究。在既往的研究显示,烷化剂并不能改善早期术后患者的生存,以铂类为基础的联合化疗(两药联合)被证明能够带来绝对的5年生存获益4%~15%[5-9]。
关于非小细胞肺癌辅助化疗的随机研究包括顺铂联合依托泊苷或长春碱类(如长春瑞滨),卡铂联合紫杉醇[6-9]。卡铂联合多西他赛多用于晚期NSCLC患者的一线治疗[10]。在该项研究中,这种组合方案的疗效与顺铂联合长春瑞滨相当,3或4级毒性包括恶心、呕吐、贫血。然而,以上不良反应的发生率在长春瑞滨组高于多西他赛联合顺铂或卡铂组。生活质量参数的改善方面,多西他赛组与长春瑞滨组是相当的。
无论是用于晚期患者的一线治疗还是用于根治性术后的辅助治疗,能否从化疗中获益很大程度上取决于能否成功完成既定疗程数的治疗[11]。就这一点而言,在既往报道的研究中,能够顺利完成辅助治疗的情况有点令人失望[7,8],这可能与接受肺部切除术的患者机体功能下降仍然需要恢复有关。在2项使用长春瑞滨联合顺铂作为辅助化疗的临床研究中,仅有58%~61%符合入组条件的患者完成至少3周期的术后化疗;在另一项研究中,有77%的患者需要至少有1次的剂量下调或停药[7],62%的患者接受了<66%计划剂量的长春瑞滨和37%的患者能够耐受<66%的总剂量顺铂[8]。然而,多西他赛联合卡铂在晚期患者的一线治疗有很好的耐受性[10]。目前仅有一项研究评估了这个方案在术后辅助治疗的安全性和耐受性,但该研究样本量小,入组时间长,影响了其预设安全目标的检验效能[12]。因此我们开展本开放性、单臂研究,对133名患者评估以上参数,CCTC联合招募患者以加速这项研究的完成。
方法
研究设计与患者资料
在这项开放性试验中,主要研究终点是安全性,定义为发热性粒细胞减少发生率<10%。根据Simon二阶段序贯设计[13]提示133例入组病例能够以90%的检验效能和5%的检验水准来校检P<0.850的零假设以及P>0.930的备择假设,其中P代表没有出现发热性中性粒细胞减少。相应地,如果接受多西他赛联合卡铂辅助化疗时出现发热性中性粒细胞减少的病例数≥14例,则此组不存在优效。
患者入组在美国一个中心(Dartmouth-Hitchcock Norris Cotton Cancer Center)和中国CCTC最早的10个中心进行。5例患者于2009年7月至9月之间入组进行启动试验,其余的128名患者随后于2009年10月至2010年4月间6个月内相继入组。2例患者此期间于美国入组,分别有39、45和47例患者于北京-天津、广州、上海入组。该试验方案经由各个中心的伦理委员会批准,并根据赫尔辛基宣言和GCP的国际协调委员会的指导方针(International Committee on Harmonization guidelines for Good Clinical Practice,ICH-GCP,E6)实施。根据GCP原则,所有患者均提供书面的知情同意书,同时成立独立数据和安全性监察委员会。
入组标准包括:经病理证实的非小细胞肺癌;完成根治性切除(R0)术后2~8周内;根据IASLC第7版TNM分期[14]分为ⅠB~ⅢA期;接受肺叶切除术、双肺叶切除术或者全肺切除术加正规纵隔淋巴结清扫术;年龄>17岁和一般状况评分(ECOG)0~1分;基线状态器官功能正常,血常规和生化常规正常。排除标准包括:患者同时并发其他恶性肿瘤;既往曾接受任何针对非小细胞肺癌的相关治疗;艾滋病毒阳性患者;有2级或以上神经病变的患者;治疗30 d内合并使用其它试验性抗癌药物;既往曾经接受过多西他赛或卡铂治疗;有铂类过敏史。
给药方法
患者接受根治性切除术并经核实符合入选标准后,签署知情同意书登记进入临床试验,接受最多3疗程的多西他赛(75 mg/m2静脉给药)联合卡铂[AUC 5.5 × (预计肌酐值 +25)]的辅助化疗。多西他赛于卡铂前给药,第一天,每3周重复。每周进行血常规监测,每疗程前检查生化常规,直到完成全部三周期化疗。每疗程化疗前均要求中性粒细胞绝对计数必须> 1 200/mm,根据不同级别的中性粒细胞减少和/或血小板下降进行药物的剂量调整。如果剂量调整超过2次,患者将出组临床研究。集落刺激因子的使用根据美国临床肿瘤协会(American Society of Clinical Oncology,ASCO) 指引给药。患者将在最后一次化疗后3个月、6个月、12个月、18个月和24个月进行随访,此后每年随访一次直到5年。
统计学分析
主要研究终点是使用多西他赛/卡铂作为辅助化疗的发热性粒细胞减少症的发生率,次要研究终点为不良事件(adverse events,AEs)、严重不良事件(serious adverse events,SAEs)、毒性(最高级别,根据CTC AE,4.0版本),剂量调整,退组率,方案耐受性(以完成计划3周期化疗数作为参数)。后续还进行了对电视辅助胸腔镜手术(video-assisted thoracoscopic surgery,VATS)和传统开胸手术对化疗实施的影响比较。两分变量比较采用卡方检验,连续变量比较使用Student t检验。P值<0.05被认为有显著性统计学差异。
结果
经过初始3个月的方案启动,2009年10月至2010年10月共完成96%的患者入组。一共有89例(67%)男性和44例(33%)女性患者,患者特征见表1。118例患者接受了肺叶切除术(89%,包括3例袖状肺叶切除术),其余的患者分别接受双肺叶切除术(7.5%)或全肺切除术(8.6%)。手术方式方面,67例(50%)的手术使用VATS技术,包括62例肺叶切除(占全部肺叶切除的53%),1例双肺叶切除术(占全部双肺叶切除术的14%),3例全肺切除术(占全部全肺切除术的38%)。
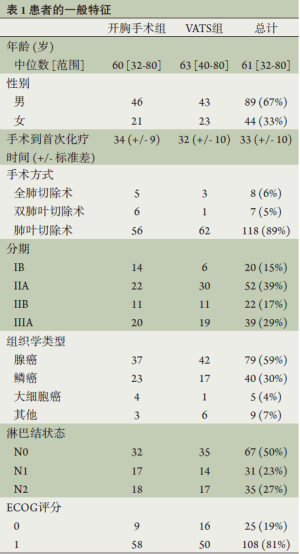
Full table
一共有115例患者(86%)完成方案计划的全部3个周期多西他赛/卡铂辅助化疗(表2)。有6例患者(4.5%)和12例(9%)患者因不良反应中断和停止化疗。在完成全部3周期化疗的患者中,仅有2例患者(1.5%)接受低于66%的卡铂计划剂量,3例(2.3%)患者接受67%~75%的卡铂计划剂量,这5例患者均接受了全量的多西他赛(表3);有4例(3.5%)患者使用多西他赛需要减量。在这些完成3个周期化疗的患者中,74例(64%)接受了全量化疗;全组一共有56%的患者接受了3周期全量的化疗。62/66例接受VAST手术的患者接受了方案计划的全部3周期的化疗,而开胸手术组为53/67例,接受VAST手术方式的患者较少出现治疗中断(P<0.01)。此外,接受VAST手术并接受全部3周期化疗的患者中仅有1例需要10%的剂量下调,而开胸手术组有16例(P<0.001)。有趣的是,VAST组和开胸手术组从手术到开始辅助化疗的时间无明显区别(分别是32±10 d和 34±9 d,P=0.4)。
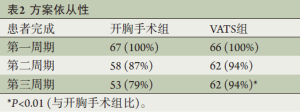
Full table
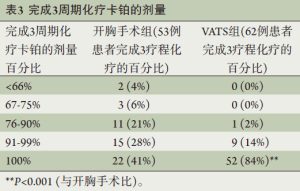
Full table
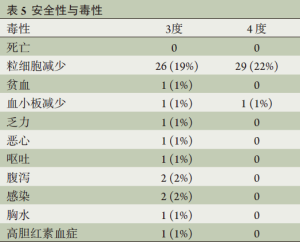
发热性粒细胞减少共见于12例(9.0%)患者,低于预设的安全性阈值14例。5例患者于第2周期化疗后出现,其余的患者出现在第3周期化疗后。仅有1例患者因发热性粒细胞减少而需住院,所有患者均无出现严重合并症并恢复正常(表4)。出现发热性粒细胞减少症的患者有4例是接受VAST手术而有8例是接受开胸手术(P=0.26)。无出现治疗相关性死亡,3或4度毒性详见表5。粒细胞减少共见于74例患者(56%),3/4度粒细胞减少见于55例患者(41%)。3/4度恶心、呕吐或腹泻仅见于3例患者(2%)。
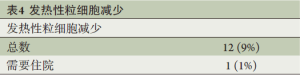
Full table
Full table
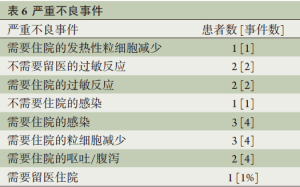
一共出现18次严重不良事件,发生于14例(10.5%)患者,包括4例使用多西他赛出现过敏而需要中断治疗,其中2例因出现低血压而需要住院(表6)。其余9次SAEs包括发热性粒细胞减少(1例)、感染(3例),严重粒细胞减少(3例)或者严重的呕吐/腹泻(2例)而需要住院,另一例SAEs是因出现盆腔感染而需要静脉注射抗生素。
Full table
讨论
按照方案的预先设定,多西他赛/卡铂方案用于NSCLC术后辅助化疗是安全的,无治疗相关死亡。发热性粒细胞减少的发生率为9%,与其他NSCLC常用的辅助或一线姑息化疗方案报道的5%~14%具有可比性[5-10,15],治疗相关住院率(11/133, 8.3%)也较低,其他SAE包括过敏或者感染,但并不需要住院治疗。其他3/4度毒性的发生率和文献报道的其他NSCLC的一线或辅助化疗相似[5-10,15]。
本研究患者的入组速度和近期NSCLC术后辅助化疗的其他临床研究相比要快得多[6-10]。实际上,数项重要的辅助化疗临床试验因招募患者困难而被提前终止[6,16]。本研究之所以能够迅速完成患者的招募,归功于CCTC的参与。这是一个近期组建的由中国国内数家顶级肿瘤中心组成完全遵守ICH-GCP原则的机构。在方案启动前,对将“西方人”的化疗剂量用于亚洲人群一直存有顾虑,因为这通常导致需要减量[17]。然而实际上,本研究中足量的多西他赛/卡铂化疗的耐受性很好。在既往报道的以卡铂为基础的NSCLC辅助化疗一样[9],本方案化疗的依从性一直都很好,86%的患者能够完成全部计划3周期的化疗,而既往报道的长春瑞滨联合顺铂的化疗的依从性仅有60%[7,8]。CCTC研究者对方案的严格执行以及本化疗方案良好的耐受性,是本方案能够获得较高的依从性的主要原因。
有一项类似的关于多西他赛/卡铂用于辅助化疗的研究在美国7个中心开展[12]。虽然该研究未能达到预设的安全性和可行性的研究终点,但总体结果和本研究非常相似,该研究报道79%的患者完成了方案的给药,发热性粒细胞减少率为11%。有趣的是,该项Ⅱ期临床研究入组72例患者需要花费接近2.5年的时间。如果他们按照这样的速度入组133例患者则需要4.5年,然而本项CCTC参与的研究仅需要6个月就完成了入组。
在本研究中,CCTC以比美国研究快一个数量级的速度完成了入组。更重要的是,这样迅速地完成入组却没有出现方案违背或者违反GCP原则。迅速完成入组的另一重要性是能够尽快把新疗法推广到临床。这种前所未有的对一个药物迅速完成平行Ⅱ期临床研究的能力将提高开发新药更广用药指征的可能,又可以避免了由于临床资源限制难以开展临床试验而忽视了新药更为重要的指征。
本研究的设计目标并非前瞻性比较传统开胸和微创VAST下手术切除术,因此患者并非随机地接受两种手术方式。但是,本研究接受两种手术方式的各亚组具有可比性,因此允许进行后续的比较。在另一项回顾性非随机研究比较了接受开胸手术的43例患者和接受胸腔镜手术的57例患者[18],VAST下肺叶切除组与传统开胸组比较有较少的化疗延迟和剂量下调。此外,61%接受VAST的患者与40%接受开胸手术的患者能够完成计划的辅助化疗(P=0.03)。在CALGB 9633临床研究中[19],仅有57%接受开胸手术的患者能完成足量的化疗,JBR10研究中有55%接受开胸手术的患者需要至少一次的化疗延迟[7]。同样的,在IALT试验中,化疗组有34%的患者能够完成全部计划的化疗而不需要延期或者剂量调整,仅有69%的患者需要接受剂量的调整或推迟化疗[20]。微创手术治疗潜在的获益主要在于能够减少术后疼痛和在化疗前获得较快的术后康复,本研究观察到VAST组有较高的治疗方案依从性,较高比例的患者能够辅按照计划剂量给药[21]。
综上所述,本研究结果显示,多西他赛联合卡铂用于NSCLC术后辅助化疗有较好的安全性与耐受性,辅助化疗的依从性在微创手术治疗组有较高的依从性。本研究的进一步随访结果有助于比较现有的其他辅助化疗临床研究与本研究方案的疗效。更重要的是,本研究成功实现了CCTC成立的宗旨:通过严格的组织和管理整合多个中心的资源和力量进行协作,改善目前现有的肿瘤防治发展。
Acknowledgement
This study was supported by a grant from Sanofi-Aventis.
Disclosure: No potential conflict of interest. Presented at the 14th World Conference on Lung Cancer, Amsterdam, July 6, 2011.
References
- Zhao Y, Kosorok MR, Zeng D. Reinforcement learning design for cancer clinical trials. Stat Med 2009;28:3294-315. [PubMed]
- Shao W, Wang D, He J. The role of gene expression profiling in early-stage non-small cell lung cancer. J Thorac Dis 2010;2:89-99. [PubMed]
- Martini N, Bains MS, Burt ME, et al. Incidence of local recurrence and second primary tumors in resected stage I lung cancer. J Thorac Cardiovasc Surg 1995;109:120-9. [PubMed]
- Voon PJ, Chul Cho B, Yeo WL, et al. The role of epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of advanced stage non-small cell lung cancer. J Thorac Dis 2010;2:144-53. [PubMed]
- Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ 1995;311:899-909. [PubMed]
- Arriagada R, Bergman B, Dunant A, et al. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med 2004;350:351-60. [PubMed]
- Winton T, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med 2005;352:2589-97. [PubMed]
- Douillard JY, Rosell R, De Lena M, et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol 2006;7:719-27. [PubMed]
- Strauss GM, Herndon JE 2nd, Maddaus MA, et al. Adjuvant paclitaxel plus carboplatin compared with observation in stage IB non-small-cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups. J Clin Oncol 2008;26:5043-51. [PubMed]
- Fossella F, Pereira JR, von Pawel J, et al. Randomized, multinational, phase III study of docetaxel plus platinum combinations versus vinorelbine plus cisplatin for advanced non-small-cell lung cancer: the TAX 326 study group. J Clin Oncol 2003;21:3016-24. [PubMed]
- Fidias P, Novello S. Strategies for prolonged therapy in patients with advanced non-small-cell lung cancer. J Clin Oncol 2010;28:5116-23. [PubMed]
- Stinchcombe TE, Harper HD, Hensing TA, et al. The feasibility of adjuvant carboplatin and docetaxel in patients with curatively resected non-small cell lung cancer. J Thorac Oncol 2008;3:145-51. [PubMed]
- Simon R. Optimal two-stage designs for phase II clinical trials. Control Clin Trials 1989;10:1-10. [PubMed]
- Goldstraw P, Crowley J, Chansky K, et al. The IASLC Lung Cancer Staging Project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classification of malignant tumours. J Thorac Oncol 2007;2:706-14. [PubMed]
- Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med 2002;346:92-8. [PubMed]
- Chhatwani L, Cabebe E, Wakelee HA. Adjuvant treatment of resected lung cancer. Proc Am Thorac Soc 2009;6:194-200. [PubMed]
- Millward MJ, Boyer MJ, Lehnert M, et al. Docetaxel and carboplatin is an active regimen in advanced non-small-cell lung cancer: a phase II study in Caucasian and Asian patients. Ann Oncol 2003;14:449-54. [PubMed]
- Petersen RP, Pham D, Burfeind WR, et al. Thoracoscopic lobectomy facilitates the delivery of chemotherapy after resection for lung cancer. Ann Thorac Surg 2007;83:1245-9; discussion 1250. [PubMed]
- Strauss GM, Herndon JE 2nd, Maddaus MA, et al. Adjuvant paclitaxel plus carboplatin compared with observation in stage IB non-small-cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups. J Clin Oncol 2008;26:5043-51. [PubMed]
- Scagliotti GV, Fossati R, Torri V, et al. Randomized study of adjuvant chemotherapy for completely resected stage I, II, or IIIA non-small-cell Lung cancer. J Natl Cancer Inst 2003;95:1453-61. [PubMed]
- He J, Shao W, Li S, et al. Feasibility Of Administering Adjuvant Chemotherapy Of Pemetrexed Followed By Pemetrexed/oxaliplatin Immediately Post-VATS In Patients With Completely Resected NSCLC. J Thorac Dis 2009;1:55-62. [PubMed]
(译者:梁颖;校对:宋勇)
(本译文仅供学术交流,实际内容请以英文原文为准。)


