既往治疗过的非小细胞肺癌的免疫治疗
介绍
支气管肺癌仍然是导致美国癌症死亡的主要原因,2017年估计有155,870人死于肺癌[1]。不幸的是,大多数人在发病时已被诊断为疾病进展期阶段,这意味着预后不良,5年生存率约为4%[2]
总的来说,在改善非小细胞肺癌(NSCLC)预后方面的有意义的进展在过去的十年中是很少的。 值得注意的是,这些结果对那些拥有对适当靶向治疗有反应的可控突变的患者更有利。 事实上,对于大多数没有可操控突变肿瘤的患者,中位存活时间约为12个月[3]。转移性非小细胞肺癌在基于铂类化疗后,再使用二线方案的标准细胞毒药物化疗,客观缓解率(ORR)和生存获益均较低[4,5]。
在补救治疗中使用的化疗组合并没有提高生存率。然而,多西紫杉醇联合抗血管内皮生长因子受体2单克隆抗体雷莫芦单抗ramucirumab,相对于单独使用多西紫杉醇,在总体生存率上显示出优势,可作为一种补救治疗的联合策略[6]。
针对程序性死亡-1 (PD-1)/程序性死亡配体1 (PD-L1)通路的免疫检查点抑制剂的开发改变了我们治疗NSCLC的方式,使其成为晚期疾病患者的公认治疗策略。鉴于近期免疫治疗的进展,癌症存活率有望增加,特别是晚期NSCLC。[7]。
PD1/PD-L1通路
肿瘤发生是一个多层面、多步骤的过程,其特征是驱动或反映肿瘤进展的基因和表观遗传改变的积累。这些变化将癌细胞与正常细胞区分开来,从而触发免疫系统识别这些外来细胞。然而,肿瘤很少被免疫系统完全排斥,这反映了癌细胞具有维持免疫抑制微环境的能力[8]。
PD-1是被激活的T细胞上发现的受体,功能是作为T细胞受体(TCR) 信号的平衡力,并充当免疫系统的“开关”防止自身免疫[9]。PD-1受体主要是在外围组织发挥作用,它允许T细胞与PD-1配体(PD-L1 (B7-H1)和PD-L2 (B7-DC))相互作用[9,10]。PD-L1在恶性肿瘤中升高,下调致敏T细胞,导致癌症的逃避、逃逸和进展[11,12]。
综上所述,免疫检查点通路在肿瘤抑制免疫监视中发挥重要作用,导致肿瘤免疫逃避。同时也是一个具有吸引力的治疗靶点。目前,有三种免疫检查点抑制剂在补救治疗方案中被批准:纳武单抗nivolumab, 派姆单抗pembrolizumab和阿特珠单抗atezolizumab(见表1)。派姆单抗Pembrolizumab最近被用于晚期非小细胞肺癌初治患者,这些患者要求肿瘤比例评分(TPS)≥50%或肿瘤PD-L1高表达,并与铂和培美曲塞联合用于转移性的非鳞非小细胞肺癌。
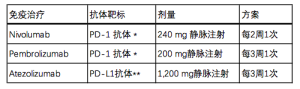
Full table
临床应用免疫治疗药物(见表2)
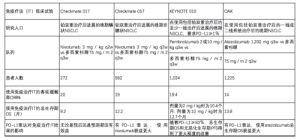
Full table
纳武单抗Nivolumab
纳武单抗Nivolumab是一种全人IgG4抗pd -1单克隆抗体,用于恢复抗肿瘤免疫[15,16]。Nivolumab是这类药物中第一个获得批准用于含铂双药化疗后的晚期非小细胞肺癌的免疫检查点抑制剂。
据报道,纳武单抗Nivolumab对包括NSCLC在内的多种实体肿瘤患者具有可控制的副作用[17]。Ib期研究纳入122例转移性非小细胞肺癌患者,其中超过一半(55%)的患者接受过三次或三次以上的治疗。纳武单抗Nivolumab以不同的剂量方案进行研究:每2周1、3或10 mg/kg的纳武单抗Nivolumab,最多2年。客观缓解率ORR为18%,反应持续时间为17个月。值得注意的是,这些反应在三种给药方案中都能看到,而且与组织学无关。纳武单抗nivolumab的反应持续时间较长,这与化疗形成鲜明对比,化疗的反应往往是短暂的。免疫检查点抑制剂在经过大量预先治疗的非小细胞肺癌患者队列中显示出显著活性,为进一步研究这类药物提供了热情。然而很明显,临床获益仅限于一小部分患者,因此需要识别用于患者选择的预测生物标志物。14%的病例报告了严重的治疗相关不良事件(AEs)。在免疫相关病因的AEs中,报道了肺炎、结肠炎、肝炎和甲状腺炎。免疫介导性肺炎占3%,严重(3/4级)肺炎占1%。值得注意的是,据报道有3人死于免疫介导性肺炎(2例NSCLC患者和1例结肠癌患者)。早期肺炎的处理需要停止治疗,开始糖皮质激素治疗或两者兼而有之并取得成功。在三名患有严重肺炎的患者中,除了糖皮质激素之外还需要额外的免疫抑制,并且给予英夫利昔单抗,霉酚酸酯或两者同时使用。
在NSCLC队列中,3 mg/kg的纳武单抗nivolumab与令人鼓舞的生存率相关,2年OS率为42%[18]。37例患者中位OS为14.9个月。PD-L1表达与预后无相关性。17%的患者达到了客观反应,这些反应是持久的,平均持续时间为17个月。反应与组织学无关(鳞状细胞与非鳞状细胞)。严重药物相关的AEs发生率为14%。发生了3例与治疗相关的肺炎死亡[18]。本阶段Ib研究的长期生存数据显示,5年OS为16%,值得注意的是,5年OS过去一直低于5%[19]。纳武单抗Nivolumab在II期临床试验中也显示出对组织学为鳞癌的转移性NSCLC患者的活性,在三线及以上的试验中,ORR为15%,1年OS为42%( CheckMate 063)[20]。
这些数据促使了两项大型III期试验的进行,CheckMate 017和CheckMate 057,研究纳武单抗nivolumab在预先治疗的晚期NSCLC患者中的应用[21,22]。
CheckMate 017[21]试图比较nivolumab与多西紫杉醇治疗进展的晚期鳞状细胞非小细胞肺癌(NSCLC)的安全性和疗效。272例患者随机分为nivolumab组和docetaxel组,nivolumab组每2周静脉注射3 mg/kg (n=135例),docetaxel组每3周静脉注射75 mg/m2(n=137例)。主要终点是OS。次要终点包括根据肿瘤PD-L1表达的疗效。两组患者中大多数都是现在或以前的吸烟者。本研究的主要终点是nivolumab组1年的OS为42%,而docetaxel组为24%,nivolumab组的ORR高于docetaxel组(20%比9%)。与多西紫杉醇相比,nivolumab治疗的反应持续时间更长,nivolumab组的中位反应持续时间没有达到,而多西紫杉醇组的反应中位数为8.4个月。nivolumab的疗效与PD-L1表达无关。严重的AEs发生率在nivolumab组( 7%)比多西他赛组(55%)低。nivolumab组无治疗相关死亡报告;而多西紫杉醇导致3例死亡(1例死于肺间质病变,1例死于肺出血,1例死于败血症并发症)。2015年3月,CheckMate 017支持批准nivolumab治疗晚期鳞状非小细胞肺癌(NSCLC),用于既往接受含铂双药化疗的患者。
CheckMate 057研究对比了nivolumab与多西紫杉醇治疗接受含铂双药化疗后的进展期非鳞状非小细胞肺癌患者的安全性和有效性[22)。582例患者随机分为nivolumab组和docetaxel组。nivolumab组每2周静脉注射3 mg/kg (n=292例),docetaxel组每3周静脉注射75 mg/m2(n=290例)。主要终点是OS。次要终点包括根据肿瘤PD-L1表达的疗效。两组患者中大多数都是现在或以前的吸烟者。这项研究的主要终点是nivolumab组的1年生存率为51%,而多西他赛组为39%。接受nivolumab治疗的患者中位OS为12.2月,而接受docetaxel治疗的患者中位OS为9.4个月。在总体研究人群中,与多西紫杉醇(12%)相比,nivolumab的ORR发生率(19%)更高。与之前报道的相似,nivolumab(17.2个月)和多西他赛(5.6个月)的反应时间更长。有趣的是,与多西他赛相比,nivolumab治疗并没有延长无进展生存期(PFS);注意PFS曲线的交叉。虽然本研究达到了其主要终点,但与PD-L1表达阴性的患者相比,肿瘤PD-L1表达患者在所有疗效终点的获益都更大。一项预先指定的亚组分析表明,nivolumab组PD-L1阴性患者的OS水平与多西他赛组相当。然而,考虑到良好的耐受性和耐久性的反应,nivolumab在这个亚组被认为是一个合理的治疗方案。与多西紫杉醇相比,nivolumab严重药物相关的AEs较低且较少见。两组各有一名患者死亡。nivolumab组的一名患者死于治疗引起的脑炎,多西他赛组的一名患者死于治疗相关的发热性中性粒细胞减少症。在2015年10月,这些结果支持了nivolumab在含铂双药化疗后用于预先治疗的晚期非鳞非小细胞肺癌患者。
在包含了2年随访的CheckMate 017中,nivolumab在OS方面继续显示出显著的优势,并显示出更大的中位反应持续时间, nivolumab组的反应时间为25.2个月,而多西他赛组为8.4个月。类似地,在CheckMate 057中,nivolumab仍然保持着OS的优势。nivolumab组的中位反应时间也明显更长, nivolumab组的反应时间为17.2个月,而多西他赛组为5.6个月。
综上所述,在这两项具有里程碑意义的试验(CheckMate 017和057)的≥2年的随访中,nivolumab的获益与OS的获益保持一致。与多西他赛相比,耐久反应率显著提高[23]。基于这些结果,nivolumab目前被认为是一种有效的治疗方法,在补救治疗中用于晚期NSCLC患者的常规治疗
派姆单抗Pembrolizumab
Pembrolizumab是一种人源化IgG4 kappa亚型抗PD-1单克隆抗体。最终的结果是破坏T细胞的抑制信号,使细胞毒性T细胞更好地识别肿瘤,并使肿瘤细胞的死亡增加。
KEYNOTE-001是一项将转移性非小细胞肺癌患者纳入多个扩展队列的I期研究。首次接受治疗和预先接受治疗的NSCLC患者在接受pembrolizumab治疗的剂量发现队列如下:每3周静脉注射2或10 mg/kg,或每2周静脉注射10 mg/kg[6,24]。主要终点是安全性、耐受性和pembrolizumab的疗效。总人口数的ORR为19.4%,预先治疗的患者ORR为18.0% (n=394),首次接受治疗的患者ORR为24.8% (n=101)。这些反应是持久的,平均反应持续时间为12.5个月。PD-L1的分析被用作一种潜在的生物预测标志物。与PD-L1比例评分低于50%的预先治疗和未接受治疗的患者相比,比例评分≥50%的患者有更高的ORR、更长时间的PFS和OS。这表明PD-L1高的肿瘤可能对免疫检查点抑制剂更敏感。最常见的AEs是疲劳、厌食症和瘙痒。9.5%的患者报告有严重的AEs。免疫相关不良事件(IRAE)报告>2%的患者包括灌注相关反应(3%),甲状腺功能减退(6.9%),肺炎(3.6%)。严重肺炎少见(1.8%),1例死亡(0.2%)。考虑到PD-L1≥50%的肿瘤患者获益更大,每3周2 mg/kg pembrolizumab被批准用于预先治疗的含铂双药化疗后的晚期NSCLC患者。
在KEYNOTE-001上,一份关于晚期NSCLC患者生存的最新报告中,首次接受治疗的患者OS中位数为22.1个月,预先接受治疗的患者OS中位数为10.6个月。首次治疗患者的18个月的OS率为58.2%,预先治疗的患者为37%;24个月的OS率分别为44.5%和31.3%。在两组患者中,OS均随着PD-L1表达的增加而增加[6]。
Pembrolizumab在KEYNOTE-010这一全球II/III期试验中进一步进行了研究,其中包括治疗前PD-L1阳性(表达≥1%)的晚期NSCLC患者[25]。共有1034名患者随机接受两种剂量的pembrolizumab:每3周2 mg/kg (n=345)或10 mg/kg (n=346),或多西紫杉醇每3周75 mg/m2(n=343)。主要终点为PD-L1≥1%和≥50%患者的OS和PFS。大多数患者以前或现在吸烟。在总人口中,两种pembrolizumab剂量(2 mg/kg 为10.4个月; 10 mg/kg为12.7个月,)与多西他赛相比较(8.5个月),OS有提高。对于总体来说,PFS的主要终点没有达到。对于PD-L1≥50%的患者,pembrolizumab组均显示PFS明显改善。与多西紫杉醇相比,Pembrolizumab尽管暴露时间更长,但耐受性更好。包括肺炎在内的IRAEs发病率较低。pembrolizumab组有3/682例(<1%)患者死于与治疗相关的肺炎。
28%的患者PD-L1≥50% (n=633),在本亚组患者中,pembrolizumab的疗效更优。pembrolizumab 2 mg/kg组中位OS为14.9个月,10 mg/kg组中位OS为17.3个月,多西紫杉醇组中位OS为8.2个月。本研究证实,pembrolizumab对PD-L1表达≥1%的预先治疗的转移性非小细胞肺癌患者有益,并扩大了对含铂双药化疗后的晚期非小细胞肺癌患者的使用批准。
阿特珠单抗Atezolizumab
Atezolizumab是一种工程化、人源化的IgG1抗PD-L1单克隆抗体,可阻断PD-L1与PD-1受体的相互作用,导致抗肿瘤t细胞活化和t细胞启动的恢复[8,26]。通过只阻断PD-L1, PD-L2-PD-1相互作用得以保留,这是一个潜在的优势,可以将自身免疫最小化[26-28]。Atezolizumab是首个经批准的在转移性NSCLC患者补救治疗中靶向PD-L1配体的单克隆抗体。
在一期和二期的临床试验表明,atezolizumab治疗的NSCLC患者获得了持久的反应。这些反应与PD-L1的表达程度有关,而PD-L1的表达是通过另一种分析确定的。使用免疫组化(IHC)分析,PD-L1不仅在肿瘤细胞中表达,还在肿瘤浸润免疫细胞中表达[8,29-31]。
POPLAR研究是一项随机II期研究,包括287名以前接受过治疗的NSCLC患者[32]。患者每3周给予阿特唑利珠单抗静脉注射1200 mg (n=144)或多西紫杉醇静脉注射75 mg/m2 (n=143)治疗。主要终点为意向治疗(ITT)人群和PD-L1亚组中的OS。采用VENTANA SP142 PD-L1免疫组化法(美国亚利桑那州图森市万塔医疗系统公司)对肿瘤细胞和肿瘤浸润免疫细胞进行PD-L1检测。这项研究达到了它的主要终点;阿特唑利珠单抗的OS改善,为12.6个月,而多西紫杉醇为9.6个月。阿特唑利珠单抗组的平均反应时间为14.3个月,而多西他赛组为7.3个月,这证实了免疫治疗亚组中这些反应的持久性。两组PD-L1阴性肿瘤患者的OS差异无统计学意义。无论PD-L1表达水平如何(无论是在肿瘤细胞上还是在肿瘤浸润淋巴细胞上),使用阿特唑利珠单抗中位OS获得改善(15.5个月),而多西紫杉醇中位OS 为(9.2个月)。阿特唑利珠单抗3/4级AEs发生率为11%,多西紫杉醇为39%。5级AEs(<1%)的发生率也低于多西他赛(2%]。
在III期OAK试验中,患者以随机方式(ITT人群)每3周接受1200mg阿特唑利珠单抗静脉注射(n=425)或多西他赛75mg/m2静脉注射(n=425)[33]。共主要终点为ITT和PD-L1表达亚组的OS(肿瘤细胞或肿瘤浸润免疫细胞上的PD-L1≥1%)。本研究的主要终点达到:在ITT和PD-L1阳性亚组中使用atezolizumab治疗获得了OS的提高。atezolizumab组中位OS为13.8个月,而docetaxel组中位OS为9.6个月。阿替唑单抗(n=241)组的TC(肿瘤细胞)1/2/3或IC(免疫细胞)1/2/3组的OS优于多西紫杉醇(n=222)。在本研究中,PD-L1低/阴性亚组(TC0和IC0)患者使用阿特唑利珠单抗的生存率更高。阿特唑利珠单抗耐受性良好。与多西紫杉醇(43%)相比,阿特唑利珠单抗具有较低的3/4级不良反应发生率(15%)。在多西紫杉醇组,报道了一例因多西紫杉醇死于呼吸道感染的病例。在atezolizumab组中没有死亡报告。
POPLAR和OAK的研究都表明,阿特唑利珠单抗治疗可以获得更好的生存,而不依赖于PD-L1和组织学(鳞癌和非鳞癌),并获得持久的反应时间。这是第一种已经被批准用于早期接受含铂双药化疗的晚期NSCLC患者的靶向PD-L1药物。
免疫检查点抑制剂的发展
度伐单抗Durvalumab是一种工程化、人源化的IgG1抗pd - l1单克隆抗体。它还避免了PD-1受体和PD-L2之间的相互作用,这可能是降低自身免疫的重要因素[34]。
在包括非小细胞肺癌在内的多种实体肿瘤的I/II期多中心研究中[35,36],度伐单抗durvalumab在晚期非小细胞肺癌亚组中产生了持久的反应,副作用可以耐受。在PD-L1阳性肿瘤患者中,每2周静脉注射10 mg/kg durvalumab的ORR为23%,PD-L1阴性肿瘤患者的ORR为5%。采用Ventana PD-L1免疫组化(SP263)对PD-L1进行分析。肿瘤表达PD-L1者有更高的ORR和OS [36]。6%的患者出现严重的AEs。2例病人(1%)发生1-2级肺炎。有几项研究探讨了在一线治疗中有或没有CTLA-4抑制剂(细胞毒性t淋巴细胞相关抗原-4抑制剂) tremelimumab的情况下,durvalumab在NSCLC中的疗效。(即, MYSTIC: NCT02453282; POSEIDON: NCT03164616)
Avelumab是一种完整的人IgG1抗pd - l1单克隆抗体,保留了天然Fc区,使抗体依赖细胞介导的细胞毒性(ADCC)成为可能。鉴于ADCC介导的肿瘤细胞裂解,后者已被证明在临床前实验中具有优势,这可能是在临床实验中与疫苗或其他免疫治疗药物联合增强avelumab活性的一个重要特征[37]。在早期试验中,无论PD-L1水平如何,Avelumab对非小细胞肺癌的初治患者都显示出持久的活性[38]。在研究的145例患者中,超过一半的患者有腺癌的组织学特征。在75例随访时间较长的患者中,ORR为19%(1例完全缓解;有12例持续应答),45%疾病稳定,疾病控制率(DCR)报告为64%。目前, Avelumab在预先治疗的晚期NSCLC的III期临床试验进行评估,该试验随机选择患者进入Avelumab组或多西紫杉醇组(JAVELIN Lung 200;NCT02395172)。
晚期非小细胞肺癌的免疫治疗与可操纵的基因组改变
关于免疫检查点抑制剂在非小细胞肺癌中的作用,以及EGFR突变或ALK重排等可操纵基因组改变的证据是有限的[39,40]。
在egfr突变体而非kras驱动的肺肿瘤中,小鼠模型显示了免疫检查点抑制剂对治疗的显著反应[40]。然而,在对58例接受免疫检查点抑制剂治疗的NSCLC患者的回顾性研究中,仅有4%的EGFR突变或ALK重排患者为应答者,23% EGFR阴性或ALK阴性或未知突变状态的患者为应答者[39]。
在一项荟萃分析中,包括三项比较免疫检查点抑制剂(nivolumab、pembrolizumab、atezolizumab)和多西紫杉醇[22,25,33]的研究,免疫治疗药物与多西紫杉醇相比显著改善了OS,尤其是在EGFR阴性亚组中。然而,这种益处在egfr突变的亚组中没有发现。对此的一种解释是egfr突变的肺癌具有较低的突变负荷,这与较低的免疫治疗反应机会有关。另一项研究证实了这一点,该研究证明EGFR阳性肺癌在下一代测序分析时突变负荷较低[41]。
在EGFR突变或ALK重排NSCLC的病例中,合适的靶向治疗是一线治疗,在发生耐药性和进展后,如果没有可操作的突变(i.e., osimertinib for T790M),下一个要考虑的治疗方案是含铂双药化疗。
PD-L1是最佳的预测生物标志物吗?
免疫检查点抑制剂的成功与否在很大程度上取决于选出最理想的患者。开发有效的生物标志物来识别真正从这些抗体中获益的患者仍然是一个活跃的研究领域[42]。虽然有一小部分NSCLC患者受益于PD-1阻断治疗,但许多患者并没有获得显著的疗效。PD-1阻断对晚期NSCLC患者免疫系统的调节机制尚不完全清楚,迫切需要进一步研究决定免疫治疗临床反应的因素。在里程碑式的研究中,肿瘤细胞和肿瘤浸润细胞上的PD-L1与临床反应和使用免疫检查点抑制剂后存活率提高有关[22,24,25,33]。
KEYNOTE 001[24]和KEYNOTE 010[25]均表明PD-L1可用于选择pembrolizumab治疗的患者。在KEYNOTE 010中,PD-L1≥1%的患者从pembrolizumab中获益。keynotes -010中报道的使用22C3克隆的PD-L1免疫组化试验之前已经得到验证,并获得了FDA的批准,作为辅助诊断试验,以帮助选择患者接受pembrolizumab治疗[43]。
然而,在CheckMate试验中,PD-L1作为预测生物标志物的影响并不清楚[21,22]。CheckMate试验采用Dako 28-8 PD-L1 免疫组化法,将PD-L1表达按三个截断值进行分类:≥1%、≥5%或≥10%。在CheckMate 017中,PD-L1表达不能预测ORR或OS。在CheckMate 057中,PD-L1表达对nivolumab的疗效具有预测作用,这与之前在I期研究中报道的类似。在PD-L1阴性肿瘤患者中,nivolumab和多西紫杉醇治疗组的OS无显著差异。值得注意的是,在三个预先指定的表达截断值(≥1%、≥5%或≥10%)上,存活率都有显著提高。基于这些结果,Dako 28-8 PD-L1免疫组化试验被批准作为补充诊断试验,但在nivolumab治疗时不需要进行患者选择[44]。
在研究atezolizumab的研究中,PD-L1的表达预示着更好的结果,包括OS。VENTANA SP142 PD-L1 免疫组化检测进行PD-L1评估是基于肿瘤细胞的百分比的分数(TC3≥50%, TC2≥5%且< 50%, TC1≥1%且 < 5%, TC0 < 1%)和肿瘤浸润免疫细胞(IC3≥10%, IC2≥5%且< 10%, IC1≥1%且< 5%,IC0 < 1%)。这种包含肿瘤浸润免疫细胞的方法对于atezolizumab的开发是独特的,这一发现在其他PD-1抑制剂研究中没有报道[32,33]。尽管如此,这还是导致了另一种评估PD-L1表达的诊断试验的批准,在本例中,该试验作为阿特唑利单抗的补充诊断试验,但在nivolumab治疗时不需要进行患者选择。
在临床应用PD-L1检测和治疗决策方面,批准多种PD-L1免疫组化检测方法以确定当前可用免疫治疗药物中的最佳治疗方案是一个独特的挑战。在患者未经治疗的情况下,pembrolizumab被批准用于PD-L1≥50%的晚期NSCLC患者(使用Dako 22C3 PD-L1 IHC试验)。在补救治疗情况中,pembrolizumab被批准用于PD-L1≥1%的晚期NSCLC患者。nivolumab和atezolizumab都被批准独立于PD-L1表达使用。鉴于使用22C3 PD-L1免疫组化法对PD-L1的评估现在是一线设置的标准,目前还不清楚该结果如何用于辅助二线方案的决策。
Blueprint PD-L1免疫组化检测比对项目是一项创新性的合作项目,旨在了解这四种PD-L1检测之间的异同(28-8; 22C3; SP142; SP263),以及这将如何影响结果。四项试验中有三项(28- 8,22c3和SP263)显示了肿瘤细胞染色的一致性,而第四项试验显示肿瘤细胞染色的一致较低[45]。所有检测均显示免疫细胞染色,但与肿瘤细胞染色相比差异较大。本研究表明,尽管三种检测方法中PD-L1表达的分析性能相似,但考虑到部分患者存在PD-L1结果不准确的风险,目前不推荐使用交替检测方法。
目前,正在进行的研究开发血液或肿瘤的预测生物标志物,以选择患者更有利于免疫检查点治疗。研究表明,突变负担或基因标记可能是帮助指导治疗决策的最佳策略[8,46,47]。
我们的研究小组评估了晚期NSCLC患者在特定时间点接受免疫检查点抑制剂的外周血,以确定外周血T细胞的变化及其与预后的关系[42]。在应答患者中,免疫检查点抑制剂治疗后发现早期PD-L1阳性CD8 t细胞反应。这些增殖的CD8 T细胞具有类似效应的表型,有可能产生细胞毒性。值得注意的是,这是一个瞬时的检测,这可能是随着肿瘤特异性效应器在肿瘤部位的增加而产生的。我们的结论是,评估外周血T细胞可能对确定治疗反应很重要,需要更多的研究来证实这些发现。
免疫相关不良反应(IRAEs)
IRAEs是PD-1/PD-L1抑制剂最常见的副作用。在大多数情况下,这些副作用是可控的。患者通常在开始治疗的前3个月经历这些IRAEs。然而,即使停止治疗,这些可能发生在治疗期间的任何时间,可以被视为一种晚期毒性[48]。
当IRAEs出现时,早期识别是至关重要的,随后应立即评估和开始治疗。治疗中度或重度IRAEs需要保持或停止治疗并使用皮质类固醇。如果皮质类固醇没有反应,则需要额外的免疫抑制。
采用综合meta分析软件对NSCLC患者抗pd -1与抗pd - l1药物的毒性进行了正式的系统回顾和汇总分析[49]。2013年至2016年,使用PD-1抑制剂的研究有12项,使用PD-L1抑制剂的研究有11项。共有5899例患者接受了毒性评估,其中3284例使用PD-1, 2615例使用PD-L1抑制剂。PD-1和PD-L1抑制剂的总AEs率相似(分别为72%和65%);3级或更差的AEs(22%和21%);分别出现疲劳、腹泻和皮疹的几率均相似。疲劳是最常见的AE,约五分之一的患者出现疲劳。甲状腺功能减退是最频繁的IRAE。与PD-L1抑制剂相比,使用PD-1抑制剂的IRAEs和肺炎发生率略高(见表3和表4)。
未来的方向
目前正在探索免疫检查点抑制剂的联合策略,以确定可能增加ORR和/或克服初始治疗后进展中患者的耐药性的新疗法。关于最佳组合和/或排序的策略尚未确定。许多组合正在研究中,包括目前批准的药物与其他针对检查点途径的药物的组合,一些是阴性检查点(如CTLA-4,LAG-3,TIM-3)或共刺激剂(如OX40,GITR),免疫调节分子[如吲哚酰胺2,3-双加氧酶(IDO)],靶向治疗或细胞毒性化疗,疫苗和放射。
目前正在进行的临床试验也在研究免疫检查点抑制剂,以评估免疫检查点抑制在早期NSCLC中的作用,包括术前[50]或术后、III期NSCLC[51]放化疗后的巩固治疗以及复发的小细胞肺癌[52]。
结论
在美国,补救治疗中使用nivolumab、pembrolizumab或atezolizumab进行免疫治疗由标准治疗方案组成。与多西他赛相比,这些免疫检查点抑制剂对晚期NSCLC患者的疗效和耐受性均有改善,因此引起了人们的热情。
然而,尽管有许多理由对加速研究高效治疗发展的潜力持乐观态度,但在确定晚期非小细胞肺癌受益最多的患者亚组方面仍存在重大挑战。
Acknowledgements
None.
Footnote
Conflicts of Interest: Dr. Leal served on scientific advisory board meetings for Genentech/Roche, Ariad, Takeda, Astrazeneca and Novartis. Dr. Ramalingam served on scientific advisory board meetings for BMS, Amgen, Abbvie, Astra Zeneca, Lilly, Genentech/Roche, and Merck.
References
- American Cancer Society. Cancer Facts & Figures 2017. Atlanta: American Cancer Society 2017.
- Howlader N, Noone AM, Krapcho M, et al. SEER Cancer Statistics Review, 1975–2013, National Cancer Institute. Bethesda, MD. 2009.
- Leighl NB. Treatment paradigms for patients with metastatic non-small-cell lung cancer: first-, second-, and third-line. Curr Oncol 2012;19:S52-8. [Crossref] [PubMed]
- Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000;18:2095-103. [Crossref] [PubMed]
- Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004;22:1589-97. [Crossref] [PubMed]
- Ramalingam S, Hui R, Gandhi L, et al. Long-Term OS for Patients With Advanced NSCLC Enrolled in the KEYNOTE-001 Study of Pembrolizumab. J Thorac Oncol 2016;11:S241-2. [Crossref] [PubMed]
- Jemal A, Ward EM, Johnson CJ, et al. Annual Report to the Nation on the Status of Cancer, 1975-2014, Featuring Survival. J Natl Cancer Inst 2017.109. [PubMed]
- Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature 2014;515:563-7. [Crossref] [PubMed]
- Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000;192:1027-34. [Crossref] [PubMed]
- Topalian SL, Drake CG, Pardoll DM. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Curr Opin Immunol 2012;24:207-12. [Crossref] [PubMed]
- Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci U S A 2002;99:12293-7. [Crossref] [PubMed]
- Topalian SL, Drake CG, Pardoll DM. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Curr Opin Immunol 2012;24:207-12. [PubMed]
- Reck M, Rodriguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016;375:1823-33. [Crossref] [PubMed]
- Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol 2016;17:1497-508. [Crossref] [PubMed]
- Wang C, Thudium KB, Han M, et al. In vitro characterization of the anti-PD-1 antibody nivolumab, BMS-936558, and in vivo toxicology in non-human primates. Cancer Immunol Res 2014;2:846-56. [Crossref] [PubMed]
- Brahmer JR, Drake CJ, Wollner I, et al. Phase I Study of Single-Agent Anti–Programmed Death-1 (MDX-1106) in Refractory Solid Tumors: Safety, Clinical Activity, Pharmacodynamics, and Immunologic Correlates. J Clin Oncol 2010;28:3167-75. [Crossref] [PubMed]
- Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012;366:2443-54. [Crossref] [PubMed]
- Gettinger SN, Horn L, Gandhi L, et al. Overall Survival and Long-Term Safety of Nivolumab (Anti-Programmed Death 1 Antibody, BMS-936558, ONO-4538) in Patients With Previously Treated Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2015;33:2004-12. [Crossref] [PubMed]
- Brahmer JR, Horn L, Jackman D, et al. Five-year follow-up from the CA209-003 study of nivolumab in previously treated advanced non-small cell lung cancer: clinical characteristics of long-term survivors. Presented at: 2017 AACR Annual Meeting. Washington, DC, 2017:Abstract CT077 2017.
- Rizvi NA, Mazières J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial. Lancet Oncol 2015;16:257-65. [Crossref] [PubMed]
- Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015;373:123-35. [Crossref] [PubMed]
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015;373:1627-39. [Crossref] [PubMed]
- Barlesi F, Steins M, Horn L, et al. Long-term outcomes with nivolumab (Nivo) vs docetaxel (Doc) in patients (Pts) with advanced (Adv) NSCLC: CheckMate 017 and CheckMate 057 2-y update. Ann Oncol 2016;27:1215PD.
- Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015;372:2018-28. [Crossref] [PubMed]
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016;387:1540-50. [Crossref] [PubMed]
- Chen DS, Irving BA, Hodi FS. Molecular pathways: next-generation immunotherapy--inhibiting programmed death-ligand 1 and programmed death-1. Clin Cancer Res 2012;18:6580-7. [Crossref] [PubMed]
- Latchman Y, Wood CR, Chernova T, et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation. Nat Immunol 2001;2:261-8. [Crossref] [PubMed]
- Akbari O, Stock P, Singh AK, et al. PD-L1 and PD-L2 modulate airway inflammation and iNKT-cell-dependent airway hyperreactivity in opposing directions. Mucosal Immunol 2010;3:81-91. [Crossref] [PubMed]
- Horn L, Spigel DR, Gettinger SN, et al. Clinical activity, safety and predictive biomarkers of the engineered antibody MPDL3280A (anti-PDL1) in non-small cell lung cancer (NSCLC): update from a phase Ia study. J Clin Oncol 2015;33:abstr 8029.
- Spigel DR, Chaft JE, Gettinger SN, et al. Clinical activity and safety from a phase II study (FIR) of MPDL3280A (anti-PDL1) in PD-L1–selected patients with non-small cell lung cancer (NSCLC). J Clin Oncol 2015;33:abstr 8028.
- Peters S, Gettinger S, Johnson ML, et al. Phase II Trial of Atezolizumab As First-Line or Subsequent Therapy for Patients With Programmed Death-Ligand 1-Selected Advanced Non-Small-Cell Lung Cancer (BIRCH). J Clin Oncol 2017;35:2781-9. [Crossref] [PubMed]
- Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016;387:1837-46. [Crossref] [PubMed]
- Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017;389:255-65. [Crossref] [PubMed]
- Stewart R, Morrow M, Hammond SA, et al. Identification and Characterization of MEDI4736, an Antagonistic Anti-PD-L1 Monoclonal Antibody. Cancer Immunol Res 2015;3:1052-62. [Crossref] [PubMed]
- Rizvi NA, Brahmer JR, Ou S-HI, et al. Safety and clinical activity of MEDI4736, an anti-programmed cell death-ligand 1 (PD-L1) antibody, in patients with non-small cell lung cancer (NSCLC). J Clin Oncol 2015;33:abstr 8032.
- Antonia SJ, Brahmer JR, Khleif S, et al. Phase 1/2 study of the safety and clinical activity of durvalumab in patients with non-small cell lung cancer (NSCLC). Ann Oncol 2016;27:416-54. [Crossref]
- Statistics NCfH: United States life tables: US decennial life tables for 1979-1981. Washington DC: US Governement Printing Office vol 1, no. 1:85-1150-1, (DHHS publication PHS). 1985.
- Jerusalem G, Chen F, Spigel D, et al. JAVELIN Solid Tumor: Safety and Clinical Activity of Avelumab (Anti-PD-L1) as First-Line Treatment in Patients with Advanced NSCLC. J Thorac Oncol 2017;12:S252. [Crossref]
- Gainor JF, Shaw AT, Sequist LV, et al. EGFR Mutations and ALK Rearrangements Are Associated with Low Response Rates to PD-1 Pathway Blockade in Non-Small Cell Lung Cancer: A Retrospective Analysis. Clin Cancer Res 2016;22:4585-93. [Crossref] [PubMed]
- Akbay EA, Koyama S, Carretero J, et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors. Cancer Discov 2013;3:1355-63. [Crossref] [PubMed]
- Spigel DR, Schrock AB, Fabrizio D, et al. Total mutation burden (TMB) in lung cancer (LC) and relationship with response to PD-1/PD-L1 targeted therapies. J Clin Oncol 2016;34:abstr 9017.
- Kamphorst AO, Pillai RN, Yang S, et al. Proliferation of PD-1+ CD8 T cells in peripheral blood after PD-1-targeted therapy in lung cancer patients. Proc Natl Acad Sci U S A 2017;114:4993-8. [Crossref] [PubMed]
- U.S. Food and Drug Administration. FDA approves Keytruda for advanced non-small cell lung cancer. Available online: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm465444.htm. Accessed October 2, 2015.
- . Accessed February 1,2018.http://wayback.archive-it.org/7993/20170111231625/http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm466576.htm
- Hirsch FR, McElhinny A, Stanforth D, et al. PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol 2017;12:208-22. [Crossref] [PubMed]
- Rizvi NA, Hellmann MD, Snyder A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science 2015;348:124-8. [Crossref] [PubMed]
- Champiat S, Ferté C, Lebel-Binay S, et al. Exomics and immunogenics: Bridging mutational load and immune checkpoints efficacy. Oncoimmunology 2014;3:e27817. [Crossref] [PubMed]
- Gordon R, Kasler MK, Stasi K, et al. Checkpoint Inhibitors: Common Immune-Related Adverse Events and Their Management. Clin J Oncol Nurs 2017;21:45-52. [Crossref] [PubMed]
- Pillai R, Behera M, Owonikoko T, et al. Evaluation of Toxicity Profile of PD-1 versus PD-L1 Inhibitors in Non-Small Cell Lung Cancer (NSCLC). J Thorac Oncol 2017;12:S253-4. [Crossref]
- Chaft JE, Forde PM, Smith KN, et al. Neoadjuvant nivolumab in early-stage, resectable non-small cell lung cancers. J Clin Oncol 2017;35:abstr 8508.
- Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after Chemoradiotherapy in Stage III Non–Small-Cell Lung Cancer. N Engl J Med 2017;377:1919-29. [Crossref] [PubMed]
- Antonia SJ, López-Martin JA, Bendell J, et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol 2016;17:883-95. [Crossref] [PubMed]
(译者:徐维章,江苏省肿瘤医院;校对:李潇,江苏省肿瘤医院)
(本译文仅供学术交流,实际内容请以英文原文为准。)




