
肺癌呼出气分析
肺癌是世界范围内导致癌症相关性死亡最常见的癌症类型,2008年有137万人死于肺癌[1,2]。与较晚期的肺癌(Ⅲ期,5年生存率23%)相比,早期诊断的肺癌(Ⅰ期)生存率较高(5年生存率67%)[3]。仅仅依靠症状不可能早期诊断肺癌,因为这些症状常在晚期才出现。在高危无症状的人群中应用新的技术早期诊断肺癌可以显著提高生存率。这篇综述的目的是阐述对肺癌患者呼出气和呼出气冷凝物(EBC)分析的相关研究进展。
背景
早在罗马时代,呼出气的气味就有助于协助医生诊断疾病。例如,甜味、丙酮气味与未控制的糖尿病有关;肝脏衰竭患者可产生鱼腥样气味;肾衰竭患者散发出尿样气味[4]。
McCulloch发现,受训后的狗可以通过闻患者呼出的气体百分之百地辨别出不同分期的肺癌和乳腺癌[5]。这说明呼出的气体中存在一些标志物,它们有助于诊断疾病。
过去的40年中,许多研究分析了呼出气体中的标志物。1971年,Pauling等用气相色谱仪(GC)从人呼出气中检测出250种不同的化合物[6]。此后Phillips分别在1997年和1999年从正常人中检测出1 259和3 000种化合物[7,8]。
呼出气分析
呼出气中的化合物与肺癌发展的过程相关。这些化合物包括:
1. 非有机化合物,例如二氧化碳、氧和一氧化氮。
2. EBC中的非挥发性化合物,例如异前列腺素、细胞因子、白三烯和过氧化氢[4]。
3. 挥发性化合物(VOCs),包括不同的类别。例如饱和的碳氢化合物(乙烷、戊烷和醛)、不饱和的碳氢化合物(异戊二烯)、含氧化合物(丙酮)、含硫化合物(乙硫醇、二甲基硫醚),以及含氮化合物(二甲醚、氨)[9]。最常检测到的VOCs是异戊二烯、丙酮、乙醇、甲醇、其他醇类及烷烃化合物[8]。
挥发性化合物(VOCs)
目前对呼出的VOCs的产生机制所知甚少。某些VOCs被认为是内源性产生的,他们是机体代谢产生的终末产物,例如异戊二烯,一种不饱和的碳氢化合物,在胆固醇合成的甲羟戊酸途径中产生[10];含氧化合物丙酮,由葡萄糖代谢途径产生;饱和碳氢化合物或烷烃化合物如乙烷和戊烷,由细胞膜的脂肪酸在氧自由基介导的脂质过氧化过程中产生[11]。后两者化合物被认为是氧化应激的标志物。VOCs的组分还包括外源性污染物,这些污染物通过肺或皮肤从外部环境中吸入得来。VOCs除了从肺部呼出外,也可以通过肝脏和肾脏代谢后排出体外[12]。
许多研究报道了各种呼吸系统疾病中检测到的VOCs,如哮喘、COPD、肺囊性纤维化和肺癌。
表1总结了在不同肺疾病中检测到的VOCs。对于一种疾病,单一的VOC没有诊断意义,而多种VOCs的组成情况才具备诊断意义[15,22]。
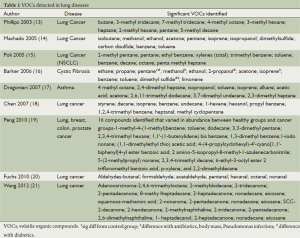
Full table
呼出气挥发性化合物(VOC)分析仪
气相色谱-质谱联用(GC-MS)
由于呼出气中VOCs浓度较低(十亿分之一,ppb)[14,16],因此需要应用敏感、高度准确的气相色谱来进行检测。表2总结了已经发表的使用GC-MS检测呼出气中VOCs的结果。气相色谱和质谱目前在临床中的应用受到限制,主要是因为该方法价格昂贵、检测过程复杂、需要高度专业的分析人员操作和分析结果。
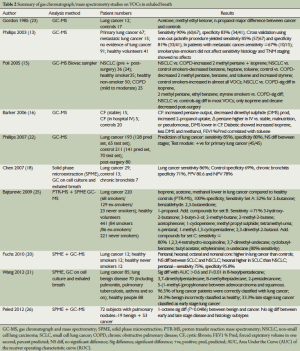
Full table
便携式/非昂贵设备
目前一些便携式的、相对低廉的设备已经应用于呼出气样本分析。他们包括:离子迁移谱仪、电子鼻设备如Cyranose 320、石英微量天平、比色仪、胶体金颗粒纳米传感器。表3总结了电子鼻设备在分析对照人群和肺癌患者呼出气VOCs的敏感性和特异性。
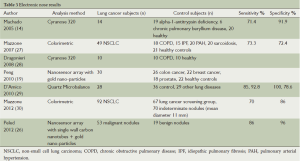
Full table
离子迁移色谱(IMS)
IMS系统的工作原理是应用550 MBq的63Ni产生的beta射线使呼出气发生电离。离子飘向电场的一级并撞击Faraday板,其速度与其大小、质量、形状有关。当离子撞击终板后,电信号会产生、积累,并形成离子谱。对于呼出气而言,离子谱如同指纹一样是特有的。Westhoff等在2009年使用IMS鉴别32名肺癌患者和54名健康人,包括吸烟者和非吸烟者,准确率达100% [31]。
电子鼻
技术的发展已发明出小型、便携式的检测设备,用于分析气化样品的化学成分。这些设备可用于检测样本中的多种化合物而不是单一的化合物。这些设备的工作原理是基于VOCs可被传感器捕获,其电导性、颜色和晶体振荡发生改变,其结果是代表多种混合的VOCs的组成情况。
石英微量天平
石英微量天平是由8个振荡石英晶体组成的传感器阵列。这些晶体包被有金属卟啉,它们吸收VOCs后会改变传感器的质量和振荡频率。每个传感器振荡频率的改变都会记录下来。
Di Natale等用石英微量天平鉴别肺癌患者(n=42)、健康志愿者(n=18)及术后的肺癌患者(n=9,其中2人术前和术后均接受检测),准确率达90.3%[32]。其中,针对肺癌患者的准确率是100%。据报道,健康人群和肺癌术后的患者有重叠。2009年 D’Amico等的研究显示,石英微量天平用于鉴别肺癌和健康非吸烟人群时,敏感性和特异性分别为85%和100%;用于鉴别肺癌和其他肺疾病患者时,敏感性和特异性分别为93%和79%[29]。
Cyranose 320
Cyranose 320是一款手持式分析仪器, 是由32个碳黑聚合物传感器组成的传感器阵列。碳黑聚合物吸收呼出气中的VOCs后膨胀,导致电阻增加。每个碳黑聚合物都有不同的特性,在吸收VOCs时整个矩阵发生的反应也不一样,传感器的综合结果即产生一份样本的“气味指纹”。
VOCs组成模式分析的统计学算法包括主要成分分析法(PCA),它将从32个传感器获得的原始数据减为四组主要成分,后者得到的是原始数据的最大方差。典型鉴别分析(CDA)所用的因素在患者中具有显著差异,用它可以创建模型,以最大化组间距离和组内距离的比值。使用Wilks'lambda法进行统计,P值小于0.05表示患者间有统计学差异。每组均值的距离用Mahalanobis距离进行量化(M距离)。M距离大于3表示组间有显著性差异(P<0.1)。完全分析所有临床组别预测模型的准确性和能力可以使用“留一交叉检验法”。交叉验证值(CVV)是指准确分类的参与者与特定参与人群的比值。
Machado 等发现,呼出气VOC成分在肺癌组(n=14)和对照组(n=20)间有差异,M距离为3.25,交叉验证的准确率(CVA)达71.6%[14]。然而,不同分期或不同组织学亚型肺癌间并无差异。但是,训练组使用新的肺癌人群(n=14)和健康人群(n=62)作为模型验证呼出气VOC组分时,电子鼻的敏感性和特异性可达到71.4%和91.9%。
2008年,Dragonieri等发现,使用Cyranose 320可有效鉴别肺癌患者(n=10)和COPD患者(n=10),其准确性为85%(M距离=3.73);用于鉴别肺癌患者和健康人群时(n=10),准确性可达90%(M距离=2.96)[28]。
比色仪
比色分析仪含有许多化学敏感化合物组成的点,例如将卟啉包被到胶片盒上。每个点都能对一系列VOCs产生反应,但反应的敏感性不一样。点吸收VOCs会发生颜色改变。胶片盒在暴露样品前后都会进行扫描,不同点颜色的改变都会被记录下来并被转换成数据。
Mazzone等[27,30]发表的两篇文章均使用比色分析仪分析肺癌患者和健康人群呼出气的VOCs成分。2007年[27],他用比色分析仪建立了一种模型鉴别肺癌人群和对照人群(包括IPF、PAH、COPD、结节病,吸烟和非吸烟的健康个体)呼出气中的VOCs,错误率为14.1%。当使用独立的验证对象组时,这一模型用于诊断肺癌的敏感性和特异性分别为73.3%、72.4%。患者吸烟史(P=0.87)、组织学类型(P=0.49)、分期(P=0.79)或肿瘤大小(P=0.69)均不影响分析结果。2012年[30],Mazzone等发现联合呼气谱和临床风险因子进行分析,包括患者年龄、性别、吸烟状况和是否并发COPD,可提高模型鉴别患者是否患有肺癌的准确率[其受试者操作特征曲线(ROC)的曲线下面积(AUC)为0.811]。使用同一模型的一项研究结果显示,鳞癌和腺癌(AUC=0.864)、早期(Ⅰ、Ⅱ期)和晚期(Ⅲ、Ⅳ期)肺癌(AUC=0.784)、生存期小于12个月和生存期大于12个月的患者呼出气特征明显不同(AUC=0.770)。
胶体金纳米传感器
Peng等[19]发明的纳米传感器由14个胶体金纳米颗粒电极组成,电极覆盖多种化合物,包括十二烷基硫醇、4-甲氧基-甲苯硫酚、己硫醇、11-巯基-1-十一烷醇、癸硫醇、十八硫醇、叔-十二烷基硫醇、1-丁硫醇、2-乙基-己硫醇、3-甲基-1-丁硫醇、2-巯基苯并恶唑、11-巯基-1-十一醇、2-巯基苄醇和3-甲基-1-丁硫醇。当14个传感器暴露呼吸气后产生电阻可逆性改变,随后进行主要成分和聚簇分析。2010年的一项研究显示,使用胶体金纳米传感器分析健康人群和肺癌、结肠癌、乳腺癌患者的呼吸气成分有所不同,但健康人群和前列腺癌的结果有重叠。当对患者人群同步进行分析时,特定的患者人群可以被鉴定出来。
在这项研究中,研究者还使用GC-MS方法研究了每名患者呼出气的VOC组成。他们发现健康者和患者的呼出气中总共有16种VOCs浓度不同。其中肺癌、结肠癌患者分别有6种VOCs浓度不同,乳腺癌患者有5种VOCs浓度不同,前列腺癌患者有4种VOCs浓度不同。然而,对于每一种癌症群体,检测到的化合物含量有重叠。Peled等[26]使用了一种由18个交叉反应的传感器组成、定制的化学纳米阵列,其中2个是单壁室碳纳米管组成的随机网络,16个是球形胶体金纳米颗粒。纳米阵列用于鉴别恶性和良性疾病的准确率可达88%,AUC为0.986。它也可以用于鉴别早期和晚期疾病(准确率88%,AUC=0.961)、腺癌和鳞癌(准确率88%,AUC=0.974)。
犬检
狗有高度发达的嗅觉,万亿分之一浓度的物质也能被检测出来。表4列举了使用犬来检测癌症的研究。
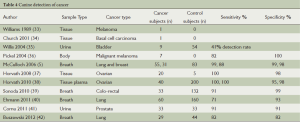
Full table
首先用狗来诊断癌症的研究者是Williams[33],他在1989年的个案中报道了一名患者的家犬对一颗痣发生了独特兴趣(后来这名患者被确诊为黑色素瘤)。2001年,Church[34]的个案也描述了一只狗会嗅探患者的皮肤病灶,之后这名患者被诊断为基底细胞癌。有意思的是,当病灶切除后,狗便再无兴趣了。
2004年,Willis等出版了第一项犬诊断癌症的研究[35]。在这项研究中,训练后的狗通过辨别尿液发出的气味诊断膀胱癌(7例中有1例阳性)。狗用来诊断癌症的准确率是41%(22/54),而机会预测的准确率是14%。Sonoda等[39]也使用受训后的狗来诊断结直肠癌,狗通过患者的呼出气来鉴别患者,其敏感性和特异性分别为91%和99%。2010年,Horvath等发现[38],狗可通过分辨组织(敏感性和特异性分别为100%和95%,)和血浆样品诊断卵巢癌(敏感性和特异性分别为100%、98%)。狗也可以用来诊断早期癌,鉴别卵巢和其他妇科恶性疾病,如子宫内膜癌、宫颈癌和外阴癌。首先用狗来诊断肺癌的研究者是McCulloch[5]。2006年他用受训后的5条狗来鉴定肺癌和乳腺癌。犬检技术对活检确诊肺癌(n=55)的敏感性是99%、特异性是99%;而对于乳腺癌(n=31),敏感性和特异性分别为88%和98%,并且所有使用的狗获得的准确率相当。然而,Ehmann等[40]的研究结果有所不同,他们使用犬检针对肺癌获得的敏感性和特异性分别为71%和93%。 Buszewski等[42]对照了色谱和犬检方法分析肺癌患者(n=29)呼出气成分的相关性,发现对于乙酸乙酯和2-戊酮,两者检测方法阳性相关(分别为r=0.85,r=0.97)。但对于乙腈、丙醛和1-丙醇,两种检测方法相关性为负相关 (r=–0.78、–0.87和–0.98)。他最后得出结论:狗可以通过对特定呼出气的气味鉴别呼出气样品,但不清楚是哪一种气味还是某些混合成分。
即使受训犬检看起来简单、花费低,但它与高质量的研究相比相差甚远[43],目前鲜有在普通人群,特别是在肺癌人群中的研究报道。
EBC分析
EBC的组成包括99%的水蒸气[44]及小部分呼吸道液滴[45]。EBC的收集比较简单、安全,是一种非侵入性检查方法,常用于分析炎症和氧化应激。患者的EBC可以通过插入到冷凝至零度的金属导管(R管)或凝结器(Ecoscreen)里的另一导管采集。患者通过此装置呼气10至20分钟后,采集和分析冷凝物。研究发现,哮喘、支气管炎、COPD和肺囊性纤维化患者[46,47]EBC中检测到炎性和氧化应激标志物升高,包括过氧化氢、白三烯、异前列腺素、氢离子和一氧化氮。Carpagnano[48-53]和Gessner[54]等则在人EBC中检测到了DNA,在36%的非小细胞肺癌患者中检测到了p53基因突变,而在对照组中未检测到该基因突变[54]。Carpagnano[53]等发现89%的非小细胞肺癌患者的EBC-DNA有微卫星改变,而只有35%的健康人群存在该变化。最近一项Carpagnano发表的研究显示[48],非小细胞肺癌患者和患有渗出性胸腔积液的对照患者EBC中的基质金属蛋白酶9(MMP-9)浓度有显著性差异(P<0.001)(二者的浓度分别为25 ng/mL和2.6 ng/mL)。作者还指出MMP-9的浓度与吸烟时间(r=0.8,P<0.0001)和肺癌的分期(r=0.6,P<0.01)呈正相关。然而,MMP-9的浓度与肺癌的组织亚型无相关。
方法学的局限性
呼出气分析的主要不足是目前尚欠缺呼气取样的参考指南。表5列举了许多可用的取样方法,这些方法差异很大,例如吸入的室内气体是需要过滤[14,19]还是不需要过滤[5,27-30,40];收集样本前(0至12分钟)患者潮式呼吸的周期如何;收集样本采用的具体方法,例如是选择潮式呼吸样本[27,29,30,40]、肺活量[5,14,28]还是肺泡呼吸样本[19];以及使用何种系统来收集样本,使用单袋手机系统[14,27-30]、双袋收集系统[19]还是使用圆柱状的聚丙烯样品采集管[5,40]。此外,使用的统计学方法也会有所不同。最后,不同检测设备间并无对照。
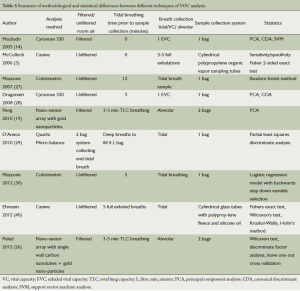
Full table
VOCs分析在肺癌中的应用
肺癌术后分析
Phillips等[22]使用GC-MS分析了非手术的肺癌患者和健康人群呼出气的不同,并且建立了用于鉴别这两种人群的数学模型。此模型用于分析术后肺癌患者,80例有77例为阳性,提示肺癌术后VOC谱并没有发生改变。这些发现表明,VOCs并不是来源于肿瘤本身而是来源于其他组织。Poli等[15]选择GC-MS识别的13种VOCs来鉴别肺癌和健康人群。术后15~30天,他重新检测了26名患者的呼出气,发现13种以前检测到的VOCs中有两种VOCs,即异戊二烯和癸烷含量变化显著。术后1个月,Poli等[55]再次测定VOCs(n=21),发现异戊二烯含量持续下降,但在术后3年(n=10),有5种VOCs发生显著改变:异戊二烯和苯的含量下降,但戊烷、甲苯和乙烯苯含量增加。肺癌术后3年患者的苯、庚烷和辛烷水平与健康人群比较没有差异。这些发现再次提示,肺癌患者呼出气中检测到的VOCs并不是来源于肿瘤。
验证研究
Machado[14]、Phillips[22]和Mazzone[27]已经使用独立的人群来验证他们使用其他受训后的人群建立的模型。表6总结了这些研究的结果。Machado等[14]使用Cyranose 320仪器检测了肺癌人群、健康人群和其他呼吸疾患者群(包括哮喘、COPD、肺动脉高压)的呼气成分。他使用支持向量机(SVM),一种学习算法来鉴别来自不同人群的呼出气,准确率达到85%,敏感性71.4%,特异性91.9%,对肺癌的阳性预测值(PPV)和阴性预测值(NPV)分别为66.6%和93.4%。2007年,Phillips[22]出版的一项研究中使用模糊逻辑法建立了肺癌患者呼出气标志物检测的模型。他基于此模型使用GC-MS方法检测了135名个体的呼出气,包括65名肺癌患者和70名健康个体,其敏感性和特异性分别为84.6%和80%,AUC值为0.88。 Mazzone[27]使用比色分析仪将他建立的模型用于分析独立人群包括肺癌、结节病、IPF、PAH、COPD和健康个体,得到的敏感性和特异性较低,分别为73.3%和72.4%。然而,当分析不确定的肺结节小于30 mm的人群时(n=29),获得的敏感性和特异性分别为100%和60%。
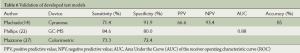
Full table
可能影响VOC分析结果的因素
年龄
2000年,Phillips等[56]使用GC-MS调查了年龄对102名正常人呼出气烷烃成分的影响。他发现,9~31岁和46~89岁两个年龄组的呼气成分有显著不同。然而,Dragonieri等[17]、Mazzone等[27]和Wehinger等[57]分别使用Cyranose 320、比色法和质子转移反应质谱(PTR-MS)获得的结果有所不同。Dragonieri等针对20名健康个体的研究结果显示,小于45岁和大于45岁人群呼气成分并无差异。Mazzone等[27]也发现,年龄并不影响检测结果(P=0.96)。Wehinger等[19]使用PTR-MS检测VOC 31(被认为是甲醛)和VOC 43(被认为是异丙醇),并未发现其与年龄相关。Peng等[19]发现使用胶体金纳米传感器检测的结果也与年龄无关。
气道口径
Lazar等[58]发现,10名哮喘患者接受乙酰胆碱和等渗盐水雾化后,使用Cyranose 320分析的呼出气谱会发生改变,但并不受气道口径影响。
吸烟
Gordon等[59]使用GC-MS法检测了5名吸烟者和5名非吸烟者的呼吸气成分,发现吸烟会对挥发性的有机成分产生影响。然而,15分钟后再次测定的VOCs会回落到基线水平。一项用Cyranose 320进行的研究显示,无论是肺癌人群还是健康人群,吸烟者和非吸烟者的呼出气谱并无差别[14]。Machado等认为,受试者间的差异很可能与疾病发展有关,而与吸烟无关。这些结果与Mazzone等的发现一致。Mazzone等[27]使用比色法来分析呼出气,检测的结果并不受吸烟史影响(目前吸烟、以前吸烟和从未吸烟)(P=0.87)。Peng等[19]也发现,受试者的吸烟习惯并不影响使用胶体金颗粒纳米传感器检测的结果。Phillips等[22,60]使用GC-MS分析了肺癌人群及有吸烟史、但CT未确诊肺癌的人群呼出气成分,并建立了一套用于鉴别这两类人群的模型。此模型的准确性已在独立的人群中进行了验证。他也发现目前吸烟和以前吸烟者的ROC曲线并无差别。Fens等[61]在使用Cyranose 320检测COPD和哮喘患者呼出气的研究中也证实,目前吸烟者和以前吸烟者的呼出气指纹没有差别(P=0.16)。
肺功能紊乱的严重程度
Machado等使用Cyranose 320对呼出气分析的结果显示,肺功能紊乱的严重程度并不影响样本的聚簇分析。
性别
许多研究显示,性别对VOCs成分谱的分析没有影响[19,27,57]。
结论
这篇综述阐述了呼出气VOCs谱、EBC遗传学标记与肺癌的相关性。
回顾研究显示,用犬来诊断肺癌有较高的敏感性和特异性,但结果仍需要在大型的临床试验中进行验证和重复,以提高诊断的准确率。使用GC和MS法检测呼出气已经鉴定了一些肺癌相关的化合物,结果证实多种VOCs而不是单一的VOC浓度会升高或下降。这些技术由于价格昂贵、操作复杂,而且需要高度专业的人员来操作和评判结果,因此临床应用受到了限制。相对而言,电子鼻及相关的设备方便、花费低,而且操作简单,临床应用可行性强。这些设备用于检测VOCs谱的原理不同;许多使用不同设备、取样技术和不同统计学方法的研究均能一致地区分肺癌患者和对照人群。联合多设备、多种方法学或多种统计学方法预测哪些高危人群易患肺癌,目前还未成现实。为了优化从高危人群中鉴定肺癌的准确率,目前需要就最适合的设备、采样技术和分析方法达成共识。目前,为了确证这些技术的敏感性和特异性,也需要对鉴别肺癌和对照人群的模型进行进一步的验证。当然,即使存在这些局限性,呼出气分析方法简便、花费低廉,做为一种新的筛查和诊断肺癌的技术,其仍有很好的应用前景。
EBC是一种可以进行遗传学标志定量分析的技术,也有一定的应用前景。但当前它在肺疾病筛选应用中并未占有一席之地,主要是因为此项技术需要匹配复杂的遗传学实验室来分析样本。
Acknowledgements
Disclosure: The authors declare no conflict of interest.
References
- Jemal A, Center MM, DeSantis C, et al. Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiol Biomarkers Prev 2010;19:1893-907. [PubMed]
- Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108. [PubMed]
- Mountain CF. Revisions in the international system for staging lung cancer. Chest 1997;111:1710-7. [PubMed]
- Buszewski B, Kesy M, Ligor T, et al. Human exhaled air analytics: biomarkers of diseases. Biomed Chromatogr 2007;21:553-66. [PubMed]
- McCulloch M, Jezierski T, Broffman M, et al. Diagnostic accuracy of canine scent detection in early- and late-stage lung and breast cancers. Integr Cancer Ther 2006;5:30-9. [PubMed]
- Pauling L, Robinson AB, Teranishi R, et al. Quantitative analysis of urine vapor and breath by gas-liquid partition chromatography. Proc Natl Acad Sci U S A 1971;68:2374-6. [PubMed]
- Phillips M. Method for the collection and assay of volatile organic compounds in breath. Anal Biochem 1997;247:272-8. [PubMed]
- Phillips M, Gleeson K, Hughes JM, et al. Volatile organic compounds in breath as markers of lung cancer: a cross-sectional study. Lancet 1999;353:1930-3. [PubMed]
- Mazzone PJ. Analysis of volatile organic compounds in the exhaled breath for the diagnosis of lung cancer. J Thorac Oncol 2008;3:774-80. [PubMed]
- Stone BG, Besse TJ, Duane WC, et al. Effect of regulating cholesterol biosynthesis on breath isoprene excretion in men. Lipids 1993;28:705-8. [PubMed]
- Kneepkens CM, Lepage G, Roy CC. The potential of the hydrocarbon breath test as a measure of lipid peroxidation. Free Radic Biol Med 1994;17:127-60. [PubMed]
- Phillips M, Herrera J, Krishnan S, et al. Variation in volatile organic compounds in the breath of normal humans. J Chromatogr B Biomed Sci Appl 1999;729:75-88. [PubMed]
- Phillips M, Cataneo RN, Cummin AR, et al. Detection of lung cancer with volatile markers in the breath. Chest 2003;123:2115-23. [PubMed]
- Machado RF, Laskowski D, Deffenderfer O, et al. Detection of lung cancer by sensor array analyses of exhaled breath. Am J Respir Crit Care Med 2005;171:1286-91. [PubMed]
- Poli D, Carbognani P, Corradi M, et al. Exhaled volatile organic compounds in patients with non-small cell lung cancer: cross sectional and nested short-term follow-up study. Respir Res 2005;6:71. [PubMed]
- Barker M, Hengst M, Schmid J, et al. Volatile organic compounds in the exhaled breath of young patients with cystic fibrosis. Eur Respir J 2006;27:929-36. [PubMed]
- Dragonieri S, Schot R, Mertens BJ, et al. An electronic nose in the discrimination of patients with asthma and controls. J Allergy Clin Immunol 2007;120:856-62. [PubMed]
- Chen X, Xu F, Wang Y, et al. A study of the volatile organic compounds exhaled by lung cancer cells in vitro for breath diagnosis. Cancer 2007;110:835-44. [PubMed]
- Peng G, Hakim M, Broza YY, et al. Detection of lung, breast, colorectal, and prostate cancers from exhaled breath using a single array of nanosensors. Br J Cancer 2010;103:542-51. [PubMed]
- Fuchs P, Loeseken C, Schubert JK, et al. Breath gas aldehydes as biomarkers of lung cancer. Int J Cancer 2010;126:2663-70. [PubMed]
- Wang Y, Hu Y, Wang D, et al. The analysis of volatile organic compounds biomarkers for lung cancer in exhaled breath, tissues and cell lines. Cancer Biomark 2012;11:129-37. [PubMed]
- Phillips M, Altorki N, Austin JH, et al. Prediction of lung cancer using volatile biomarkers in breath. Cancer Biomark 2007;3:95-109. [PubMed]
- Gordon SM, Szidon JP, Krotoszynski BK, et al. Volatile organic compounds in exhaled air from patients with lung cancer. Clin Chem 1985;31:1278-82. [PubMed]
- Ellis JR, Gleeson FV. Lung cancer screening. Br J Radiol 2001;74:478-85. [PubMed]
- Bajtarevic A, Ager C, Pienz M, et al. Noninvasive detection of lung cancer by analysis of exhaled breath. BMC Cancer 2009;9:348. [PubMed]
- Peled N, Hakim M, Bunn PA Jr, et al. Non-invasive breath analysis of pulmonary nodules. J Thorac Oncol 2012;7:1528-33. [PubMed]
- Mazzone PJ, Hammel J, Dweik R, et al. Diagnosis of lung cancer by the analysis of exhaled breath with a colorimetric sensor array. Thorax 2007;62:565-8. [PubMed]
- Dragonieri S, Annema JT, Schot R, et al. An electronic nose in the discrimination of patients with non-small cell lung cancer and COPD. Lung Cancer 2009;64:166-70. [PubMed]
- D'Amico A, Pennazza G, Santonico M, et al. An investigation on electronic nose diagnosis of lung cancer. Lung Cancer 2010;68:170-6. [PubMed]
- Mazzone PJ, Wang XF, Xu Y, et al. Exhaled breath analysis with a colorimetric sensor array for the identification and characterization of lung cancer. J Thorac Oncol 2012;7:137-42. [PubMed]
- Westhoff M, Litterst P, Freitag L, et al. Ion mobility spectrometry for the detection of volatile organic compounds in exhaled breath of patients with lung cancer: results of a pilot study. Thorax 2009;64:744-8. [PubMed]
- Di Natale C, Macagnano A, Martinelli E, et al. Lung cancer identification by the analysis of breath by means of an array of non-selective gas sensors. Biosens Bioelectron 2003;18:1209-18. [PubMed]
- Williams H, Pembroke A. Sniffer dogs in the melanoma clinic? Lancet 1989;1:734. [PubMed]
- Church J, Williams H. Another sniffer dog for the clinic? Lancet 2001;358:930. [PubMed]
- Willis CM, Church SM, Guest CM, et al. Olfactory detection of human bladder cancer by dogs: proof of principle study. BMJ 2004;329:712. [PubMed]
- Pickel D. Evidence for canine olfactory detection of melanoma. Appl Anim Behav Sci 2004;89:107-16.
- Horvath G, Jarverud GA, Jarverud S, et al. Human ovarian carcinomas detected by specific odor. Integr Cancer Ther 2008;7:76-80. [PubMed]
- Horvath G, Andersson H, Paulsson G. Characteristic odour in the blood reveals ovarian carcinoma. BMC Cancer 2010;10:643. [PubMed]
- Sonoda H, Kohnoe S, Yamazato T, et al. Colorectal cancer screening with odour material by canine scent detection. Gut 2011;60:814-9. [PubMed]
- Ehmann R, Boedeker E, Friedrich U, et al. Canine scent detection in the diagnosis of lung cancer: revisiting a puzzling phenomenon. Eur Respir J 2012;39:669-76. [PubMed]
- Cornu JN, Cancel-Tassin G, Ondet V, et al. Olfactory detection of prostate cancer by dogs sniffing urine: a step forward in early diagnosis. Eur Urol 2011;59:197-201. [PubMed]
- Buszewski B, Ligor T, Jezierski T, et al. Identification of volatile lung cancer markers by gas chromatography-mass spectrometry: comparison with discrimination by canines. Anal Bioanal Chem 2012;404:141-6. [PubMed]
- McCulloch M, Turner K, Broffman M. Lung cancer detection by canine scent: will there be a lab in the lab? Eur Respir J 2012;39:511-2. [PubMed]
- Effros RM, Hoagland KW, Bosbous M, et al. Dilution of respiratory solutes in exhaled condensates. Am J Respir Crit Care Med 2002;165:663-9. [PubMed]
- Effros RM, Dunning MB 3rd, Biller J, et al. The promise and perils of exhaled breath condensates. Am J Physiol Lung Cell Mol Physiol 2004;287:L1073-80. [PubMed]
- Montuschi P. Analysis of exhaled breath condensate in respiratory medicine: methodological aspects and potential clinical applications. Ther Adv Respir Dis 2007;1:5-23. [PubMed]
- Grob NM, Aytekin M, Dweik RA. Biomarkers in exhaled breath condensate: a review of collection, processing and analysis. J Breath Res 2008;2:037004. [PubMed]
- Carpagnano GE, Costantino E, Palladino GP, et al. Microsatellite alterations and cell-free DNA analysis: could they increase the cytology sensitivity in the diagnosis of malignant pleural effusion? Rejuvenation Res 2012;15:265-73. [PubMed]
- Carpagnano GE, Foschino-Barbaro MP, Mule G, et al. 3p microsatellite alterations in exhaled breath condensate from patients with non-small cell lung cancer. Am J Respir Crit Care Med 2005;172:738-44. [PubMed]
- Carpagnano GE, Foschino-Barbaro MP, Resta O, et al. Endothelin-1 is increased in the breath condensate of patients with non-small-cell lung cancer. Oncology 2004;66:180-4. [PubMed]
- Carpagnano GE, Foschino-Barbaro MP, Spanevello A, et al. 3p microsatellite signature in exhaled breath condensate and tumor tissue of patients with lung cancer. Am J Respir Crit Care Med 2008;177:337-41. [PubMed]
- Carpagnano GE, Palladino GP, Martinelli D, et al. Exhaled matrix metalloproteinase-9 in lung cancer. Rejuvenation Res 2012;15:359-65. [PubMed]
- Carpagnano GE, Spanevello A, Carpagnano F, et al. Prognostic value of exhaled microsatellite alterations at 3p in NSCLC patients. Lung Cancer 2009;64:334-40. [PubMed]
- Gessner C, Kuhn H, Toepfer K, et al. Detection of p53 gene mutations in exhaled breath condensate of non-small cell lung cancer patients. Lung Cancer 2004;43:215-22. [PubMed]
- Poli D, Goldoni M, Caglieri A, et al. Breath analysis in non small cell lung cancer patients after surgical tumour resection. Acta Biomed 2008;79:64-72. [PubMed]
- Phillips M, Cataneo RN, Greenberg J, et al. Effect of age on the breath methylated alkane contour, a display of apparent new markers of oxidative stress. J Lab Clin Med 2000;136:243-9. [PubMed]
- Wehinger A. Lung cancer detection by proton transfer reaction mass-spectrometric analysis of human breath gas. Int J Mass Spectrom 2007;265:49-59.
- Lazar Z, Fens N, van der Maten J, et al. Electronic nose breathprints are independent of acute changes in airway caliber in asthma. Sensors (Basel) 2010;10:9127-38. [PubMed]
- Gordon SM, Wallace LA, Brinkman MC, et al. Volatile organic compounds as breath biomarkers for active and passive smoking. Environ Health Perspect 2002;110:689-98. [PubMed]
- Phillips M, Altorki N, Austin JH, et al. Detection of lung cancer using weighted digital analysis of breath biomarkers. Clin Chim Acta 2008;393:76-84. [PubMed]
- Fens N, Zwinderman AH, van der Schee MP, et al. Exhaled breath profiling enables discrimination of chronic obstructive pulmonary disease and asthma. Am J Respir Crit Care Med 2009;180:1076-82. [PubMed]
(译者:王俊、串俊兰;校对:叶伶云)
(本译文仅供学术交流,实际内容请以英文原文为准。)


